题目内容
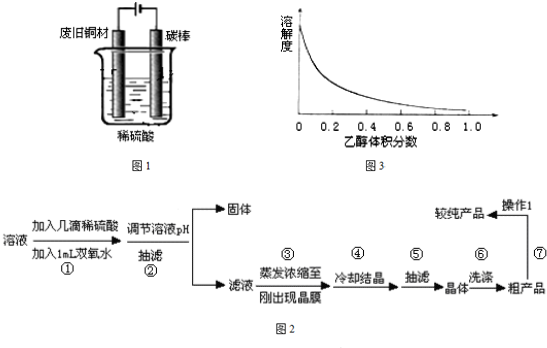
Ⅰ:制备硫酸铜装置如图1,写出阳极发生的电极反应式
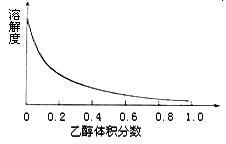
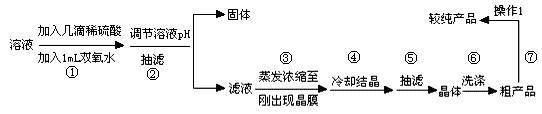
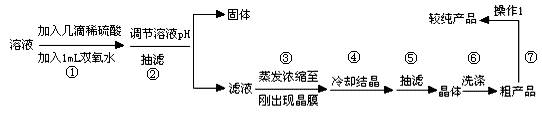
Ⅱ:提纯硫酸铜待反应结束后,取出电极,按照如流程图2提纯得到硫酸铜晶体(CuSO4?5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH | Fe2+ | 6.4 | 8.4 | Fe3+ | 2.4 | 3.1 | Cu2+ | 5.2 | 6.5 |
(2)步骤②中可加入
(3)步骤③不能蒸干的原因是
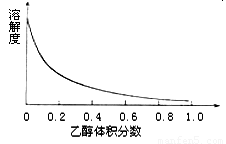
(4)图3表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)写出步骤①发生反应的离子方程式
Ⅱ、(1)操作1是从粗产品中获得比较纯的硫酸铜晶体,应采取重结晶操作;
(2)步骤②的目的是调节溶液pH值,将溶液中Fe3+的转化为氢氧化铁而除去,且铜离子不能沉淀,加入的药品不能引入新杂质,可以用CuO、CuCO3等,结合离子开始沉淀与沉淀完全的pH可知,应调节溶液pH在3.1~5.2之间;
(3)步骤③若蒸干,硫酸铜晶体会失去结晶水;
(4)由图中数据可知,乙醇的体积分数越大,硫酸铜的溶解度越小,故洗涤硫酸铜晶体时,应使用体积分数较大的酒精溶液,既可以洗去附着的杂质又可以减少硫酸铜晶体的损失;
(5)步骤①加入过氧化氢,将亚铁离子氧化为铁离子,便于调节溶液pH值除去.
Ⅱ、(1)操作1是从粗产品中获得比较纯的硫酸铜晶体,应采取重结晶操作,
故答案为:重结晶;
(2)步骤②的目的是调节溶液pH值,将溶液中Fe3+的转化为氢氧化铁而除去,且铜离子不能沉淀,加入的药品不能引入新杂质,可以用CuO、CuCO3等,结合离子开始沉淀与沉淀完全的pH可知,应调节溶液pH在3.1~5.2之间,
故答案为:CuO或CuCO3;3.1~5.2;
(3)步骤③不能蒸干,防止硫酸铜晶体失去结晶水,
故答案为:防止硫酸铜晶体失去结晶水;
(4)由图中数据可知,乙醇的体积分数越大,硫酸铜的溶解度越小,故洗涤硫酸铜晶体时,应使用体积分数较大的酒精溶液,既可以洗去附着的杂质又可以减少硫酸铜晶体的损失,故选95%乙醇溶液,
故答案为:C;
(5)步骤①加入过氧化氢,将亚铁离子氧化为铁离子,便于调节溶液pH值除去,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O.

(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
(1)写出步骤①发生反应的离子方程式 。
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 。
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)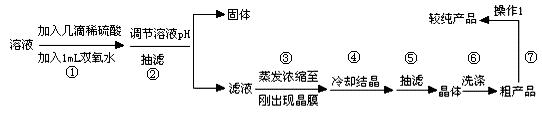
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
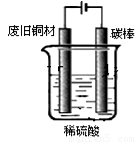
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式 。
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 。
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图,写出阳极发生的电极反应式 ▲ 、
▲ 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式 ▲ 。
(2)步骤②中可加入 ▲ (填化学式)调节溶液pH至 ▲ (填范围)。
(3)步骤③不能蒸干的原因是 ▲ 。
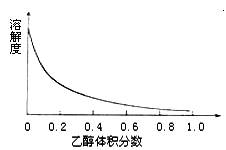
(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 ▲ 。