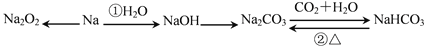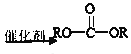题目内容
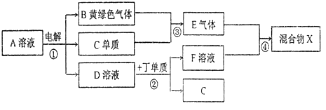
【题目】有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电权电解(有阳离子交换膜)![]() 的A溶液。
的A溶液。
请按要求回答下列问题:
①.己元素与丙元素同主族,比丙原子多2个电子层,则己的原子序数为________;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是__________________________________________________。
②.甲、乙、戊按原子个数比1︰1︰1形成的化合物Y具有漂白性,其电子式为_______________。
③.上图转化关系中不属于氧化还原反应的有(填编号)_______。
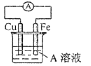
④.接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为_____________________。
⑤.当反应①电解一段时间后测得D溶液pH=12(常温下,假设气体完全逸出,取出交换膜后溶液充分混匀,忽略溶液体积变化),此时共转移电子数目约为___________;反应②的离子方程式为_________
⑥.若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有___________
【答案】(1)37;依据同主族元素的金属性随核电荷数的增加而增强,推测己单质与水反应较丙更剧烈(1分,合理给分)
(2)![]() ;(3)④;
;(3)④;
(4)3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓;
(5)6.02×l021; 2A1+2OH-+2H2O=2AlO2-+3H2↑ ;
(6)NaCl、Al(OH)3
【解析】
试题根据题意可知:A是NaCl,B是Cl2,C是H2,D是NaOH,E是HCl,丁是Al,F是NaAlO2;X是NaCl、AlCl3的混合物。根据元素的化合价及元素的原子序数的关系可知甲是H,乙是O,丙是Na,丁是Al,戊是Cl,己是Rb,原子序数是37;钠、铷 同一主族的元素,由于从上到下原子半径逐渐增大,原子失去电子的能力逐渐增强,所以它们与水反应的能力逐渐增强,反应越来越剧烈;(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y是HClO,该物质具有强的氧化性,故具有漂白性,其电子式为![]() ;(3)在上图转化关系中①②③反应中有元素化合价的变化,所以属于氧化还原反应,而④中元素的化合价没有发生变化,所以该反应是非氧化还原反应;(4)如构成原电池,Fe被腐蚀,则Fe为负极,发生反应:Fe-2e-=Fe2+,Fe2+与[Fe(CN)6]3-会发生反应产生蓝色沉淀,反应的离子方程式是:3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓;(5)NaCl溶液电解的化学方程式是:2NaCl+2H2O
;(3)在上图转化关系中①②③反应中有元素化合价的变化,所以属于氧化还原反应,而④中元素的化合价没有发生变化,所以该反应是非氧化还原反应;(4)如构成原电池,Fe被腐蚀,则Fe为负极,发生反应:Fe-2e-=Fe2+,Fe2+与[Fe(CN)6]3-会发生反应产生蓝色沉淀,反应的离子方程式是:3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓;(5)NaCl溶液电解的化学方程式是:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,在该反应中,每转移2mol电子,反应会产生2molNaOH,n(NaCl)=1L×1mol/L=1mol,当NaCl电解完全后反应转移1mol电子,反应产生1molNaOH,当反应①电解一段时间后测得D溶液pH=12,n(NaOH)=10-2mol/L×1L=0.01mol<1mol,说明NaCl没有完全电解,则电子转移的物质的量是0.01mol,电子转移的数目约是N(e-)=0.01mol×6.02×1023/mol= 6.02×l021;反应②是Al与NaOH溶液反应,反应的离子方程式为2A1+2OH-+2H2O=2AlO2-+3H2↑;(6)若上图中各步反应均为恰好完全转化,则4HCl+NaAlO2=NaCl+AlCl3,所以混合物X中含有的物质是NaCl、Al(OH)3。
Cl2↑+H2↑+2NaOH,在该反应中,每转移2mol电子,反应会产生2molNaOH,n(NaCl)=1L×1mol/L=1mol,当NaCl电解完全后反应转移1mol电子,反应产生1molNaOH,当反应①电解一段时间后测得D溶液pH=12,n(NaOH)=10-2mol/L×1L=0.01mol<1mol,说明NaCl没有完全电解,则电子转移的物质的量是0.01mol,电子转移的数目约是N(e-)=0.01mol×6.02×1023/mol= 6.02×l021;反应②是Al与NaOH溶液反应,反应的离子方程式为2A1+2OH-+2H2O=2AlO2-+3H2↑;(6)若上图中各步反应均为恰好完全转化,则4HCl+NaAlO2=NaCl+AlCl3,所以混合物X中含有的物质是NaCl、Al(OH)3。

【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S | K1=9.1×10-8K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为_______mol/L;此时温度__________25 ℃(填“大于”,“小于”或“等于”),若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为______mol/L。
(2)下列四种离子结合H+能力最强的是______。
A.HCO3- B. C2O42- C. S2- D.CH3COO-
(3)该温度下1.0 mol·L-1的CH3COOH溶液中的c(H+)=_____span> mol·L-1
(4)常温下,加水稀释0.1 mol·L-1的H2C2O4溶液,下列说法正确的是(______)
A.溶液中n(H+)×n(OH-)保持不变
B.溶液中水电离的c(H+)×c(OH-)保持不变
C.溶液中c(HC2O4-)/c(H2C2O4)保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为__________________________。