��Ŀ����
��8�֣����¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
|
��ѧ����ʽ |
K (T1 ) |
K (T2) |
|
F2+H2 |
1.8 ��1036 |
1.9 ��1032 |
|
Cl2+H2 |
9.7 ��1012 |
4.2 ��1011 |
|
Br2+H2 |
5.6 ��107 |
9.3 ��106 |
|
I2+H2 |
43 |
34 |
��1��������K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ�_______��ѡ����ĸ��
a.����ͬ�����£�X2��ƽ��ת�������� b. X2��H2��Ӧ�ľ��ҳ̶�����
c. HX���ȶ������� d. HX�Ļ�ԭ������
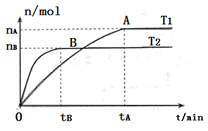
��2�����ݻ�Ϊ3L���ܱ������У���I2(g)��H2(g)�ϳ�HI(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬HI�����ʵ����ı仯�������ͼ��ʾ��

���¶�ΪT1ʱ����0~tAmin�ڣ�H2����������v (H2)=__________
�ڷ�����ͼ��ʾͼ������˵����ȷ����________������ţ�
a.�¶�ΪT2�������������ܶȲ���ʱ����Ӧ����B����ʾ״̬
b.ƽ��״̬��A���ƶ���B�㣬n(HI)/n(H2)����
c.�÷�ӦΪ���ȷ�Ӧ
(3)��ˮϡ��0.1mol��L-1��HF��Һ�����и������������________������ţ�
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
��1��ac��2����nA/6tA ��c ��3��d
����������1��ƽ�ⳣ��Խ��Ӧ���ת����Խ����Ӧ����̶�Խ������⻯����ȶ��Ծ�Խǿ��
��2���ٸ���ͼ���֪����0��tAmin�ڣ����ɵĵ⻯����nAmol��������������0.5 nAmol�����Է�Ӧ������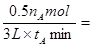 nA/6tAmol/(L��min)��
nA/6tAmol/(L��min)��
����Ϊ��Ӧǰ��������䣬���Ի�������ܶ�ʼ���Dz���ġ�B�����ȴﵽƽ��״̬������B���Ӧ���¶ȸߡ���A�㵽B��⻯������ʵ������٣�ƽ�����淴Ӧ�����ƶ�������n(HI)/n(H2)��С�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����������Ӧ�����ȷ�Ӧ��
��4��HF����������ʣ����ڵ���ƽ��HF F����H����ϡ�������ڵ��룬����ϡ�����������Ӻͷ����ӵ����ʵ��������ӵģ�����Ũ��������ģ�����OH����Ũ��������ġ�HF�����ʵ����Ǽ�С�ģ�Ũ��Ҳ�Ǽ�С�ġ�����Ⱥ��¶��йأ�ϡ���Dz���ģ������ȷ�Ĵ���d��
F����H����ϡ�������ڵ��룬����ϡ�����������Ӻͷ����ӵ����ʵ��������ӵģ�����Ũ��������ģ�����OH����Ũ��������ġ�HF�����ʵ����Ǽ�С�ģ�Ũ��Ҳ�Ǽ�С�ġ�����Ⱥ��¶��йأ�ϡ���Dz���ģ������ȷ�Ĵ���d��

| ��ѧ����ʽ | K��t1�� | K��t2�� |
| F2+H2?2HF | 1.8��1036 | 1.9��1032 |
| Cl+H2?2HCl | 9.7��1012 | 4.2��1011 |
| Br2+H2=2HBr | 5.6��107 | 9.3��106 |
| I2+H2=2HI | 43 | 34 |
| A������ͬ����������±��ԭ�Ӻ˵���������ӣ�ƽ��ʱX2��ת�������� |
| B��t2��t1��HX�����ɷ�Ӧ�����ȷ�Ӧ |
| C������±��ԭ�Ӻ˵����������HX�Ļ�ԭ������ |
| D������±��ԭ�Ӻ˵����������HX���ȶ�������ǿ |
���¶�t1��t2�£�X2(g)��H2��Ӧ����HX��ƽ�ⳣ�����±���
| ��ѧ����ʽ | K(t1) | K(t2) |
| F2+H2 | 1.8��1036 | 1.9��1032 |
| Cl2+H2 | 9.7��1012 | 4.2��1011 |
| Br2+H2 | 5.6��107 | 9.3��106 |
| I2+H2 | 43 | 34 |
����֪t2>t1��HX�����ɷ�Ӧ�� ��Ӧ������ȡ����ȡ�����
��HX�ĵ���ʽ�� ��
�ǹ��ۼ��ļ����湲�õ��Ӷ�ƫ�Ƴ̶ȵ��������ǿ��HX���ۼ��ļ�����ǿ������˳���� ��
��X2������H2��Ӧ����HX����ԭ�ӽṹ����ԭ�� ��
��K�ı仯���ֳ�X2��ѧ���ʵĵݱ��ԣ���ԭ�ӽṹ����ԭ�� ��ԭ�Ӱ뾶�����õ�������������
�ʽ�����K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ� ��ѡ����ĸ����
a.����ͬ�����£�ƽ��ʱX2��ת��������
b. X2��H2��Ӧ�ľ��ҳ̶�����
c.HX�Ļ�ԭ������
d.HX���ȶ�������
(9��)���¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
| ��ѧ����ʽ | K (T1 ) | K (T2) |
| F2+H2 | 1.8 ��1036 | 1.9 ��1032 |
| Cl2+H2 | 9.7 ��1012 | 4.2 ��1011 |
| Br2+H2 | 5.6 ��107 | 9.3 ��106 |
| I2+H2 | 43 | 34 |
��1��������K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ�_______��ѡ����ĸ��
a. ����ͬ�����£�X2��ƽ��ת�������� b. X2��H2��Ӧ�ľ��ҳ̶�����
c. HX���ȶ������� d. HX�Ļ�ԭ����
��2�����ݻ�Ϊ3L���ܱ������У���I2(g)��H2(g)�ϳ�HI(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬HI�����ʵ����ı仯�������ͼ��ʾ��
���¶�ΪT1ʱ����0~tAmin�ڣ�H2����������v (H2)=__________
�ڷ�����ͼ��ʾͼ������˵����ȷ����________������ţ�
a���¶�ΪT2�������������ܶȲ���ʱ����Ӧ����B����ʾ״̬
b��ƽ��״̬��A���ƶ���B�㣬n(HI)/n(H2)����
c���÷�ӦΪ���ȷ�Ӧ
(3)��ˮϡ��0.1mol��L-1��HF��Һ�����и������������________������ţ�
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
��4����0.1mol��L-1HCl��Һ�м������AgNO3��Һ��������ɫ�������ٵμ�KI��Һ�����ֻ�ɫ��������д���йص����ӷ���ʽ �� ��
(9��)���¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
| ��ѧ����ʽ | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 �� 1036 1036 | 1.9 ��1032 |
Cl2+H2  2HCl 2HCl | 9.7 ��1012 | 4.2 ��1011 |
Br2+H2  2HBr 2HBr | 5.6 ��107 | 9.3 ��106 |
I2+H2  2HI 2HI | 43 | 34 |
a. ����ͬ�����£�X2��ƽ��ת�������� b. X2��H2��Ӧ�ľ��ҳ̶�����
c. HX���ȶ������� d. HX�Ļ�ԭ����
��2�����ݻ�Ϊ3L���ܱ������У���I2(g)��H2(g)�ϳ�HI(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬HI�����ʵ����ı仯�������ͼ��ʾ��
���¶�ΪT1ʱ����0~tAmin�ڣ�H2����������v (H2)=__________
�ڷ�����ͼ��ʾͼ������˵����ȷ����________������ţ�
a���¶�ΪT2�������������ܶȲ���ʱ����Ӧ����B����ʾ״
 ̬
̬b��ƽ��״̬��A���ƶ���B�㣬n(HI)/n(H2)����
c���÷�ӦΪ���ȷ�Ӧ
(3)��ˮϡ��0.1mol��L-1��HF��Һ�����и������������________������ţ�
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
��4����0.1mol��L-1HCl��Һ�м������AgNO3��Һ��������ɫ�������ٵμ�KI��Һ�����ֻ�ɫ��������д���йص����ӷ���ʽ �� ��
 2HF
2HF  2HF
2HF 2HCl
2HCl 2HBr
2HBr 2HI
2HI