题目内容
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2 | 1.8×1036 | 1.9×1032 |
| Cl2+H2 | 9.7×1012 | 4.2×1011 |
| Br2+H2 | 5.6×107 | 9.3×106 |
| I2+H2 | 43 | 34 |
⑴已知t2>t1,HX的生成反应是 反应(填“吸热”或“放热”)。
⑵HX的电子式是 。
⑶共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 。
⑷X2都能与H2反应生成HX,用原子结构解释原因: 。
⑸K的变化体现出X2化学性质的递变性,用原子结构解释原因: ,原子半径逐渐增大,得电子能力逐渐减弱。
⑹仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加, (选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
⑴放热 ⑵H:![]() X: ⑶HF、HCl、HBr、HI ⑷卤素原子的最外层电子数均为7 ⑸同一主族元素从上到下原子核外电子层数依次增多 ⑹ad
X: ⑶HF、HCl、HBr、HI ⑷卤素原子的最外层电子数均为7 ⑸同一主族元素从上到下原子核外电子层数依次增多 ⑹ad
解析:温度升高,平衡常数减小,说明平衡向逆反应方向移动,正反应为放热反应;F、Cl、Br、I的得电子能力依次减小,故HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI;X2都能与H2反应生成HX的原因是卤素原子的最外层电子数均为7,得一个电子或形成一个共用电子对时,即可形成8电子稳定结构;平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱造成的。

| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2=2HBr | 5.6×107 | 9.3×106 |
| I2+H2=2HI | 43 | 34 |
| A、在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低 |
| B、t2>t1,HX的生成反应是吸热反应 |
| C、随着卤素原子核电荷数的增加HX的还原性逐渐减弱 |
| D、随着卤素原子核电荷数的增加HX的稳定性逐渐增强 |
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
| F2+H2 | 1.8 ×1036 | 1.9 ×1032 |
| Cl2+H2 | 9.7 ×1012 | 4.2 ×1011 |
| Br2+H2 | 5.6 ×107 | 9.3 ×106 |
| I2+H2 | 43 | 34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
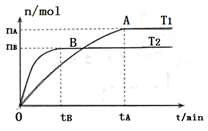
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 × 1036 1036 | 1.9 ×1032 |
Cl2+H2  2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
I2+H2  2HI 2HI | 43 | 34 |
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状
 态
态b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
 2HF
2HF 2HCl
2HCl 2HBr
2HBr 2HI
2HI