题目内容
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案环己烯是一种重要的化工原料。
(1)实验室可由环己醇制备环己烯,反应的化学方程式是______________________________________________________。
(2)实验装置如下图所示,将10 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
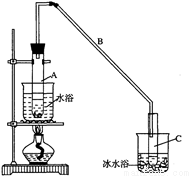
环己醇和环己烯的部分物理性质如下:
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
① A中碎瓷片的作用是_____________;导管B除了导气外还具有的作用是___________________。
② 试管A置于水浴中的目的是_________________________________;
试管C置于冰水浴中的目的是_______________________________。
(3)环己烯粗品中含有少量环己醇和酸性杂质。精制环己烯的方法是:
① 向环己烯粗品中加入_________(填入编号),充分振荡后,___________________(填操作名称)。
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
② 再对初步除杂后的环己烯进行蒸馏,得到环己烯精品。蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是__________________________。
③ 实验制得的环己烯精品质量低于理论产量,可能的原因是_______________。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是________________。
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象

