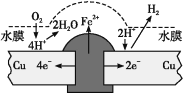
题目内容
【题目】PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl,现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
(1)Ca3(PO4)2(已知式量310)沉淀的质量____________;
(2)滤液中溶质的物质的量浓度__________________。
【答案】9.3 g c[Ca(OH)2] = 0.005 mol/L,c[CaCl2] = 0.044 mol/L
【解析】
(1)n[Ca(OH)2]=![]() =0.2125mol。P元素失电子,氧元素得电子,设PCl3的物质的量是zmol,由得失电子守恒知:0.020mol×2(2-0)=z(5-3)mol,解得n(PCl3)=0.04mol。过滤后得到2.5L滤液,测得pH为12,即溶液中c(OH-)=0.01mol/L,所以过量n[Ca(OH)2]=0.0125mol,反应掉0.2mol,根据PCl3+3H2O→H3PO3+3HCl可知0.04molPCl3和水反应会生成0.04molH3PO3、0.12molHCl,需
=0.2125mol。P元素失电子,氧元素得电子,设PCl3的物质的量是zmol,由得失电子守恒知:0.020mol×2(2-0)=z(5-3)mol,解得n(PCl3)=0.04mol。过滤后得到2.5L滤液,测得pH为12,即溶液中c(OH-)=0.01mol/L,所以过量n[Ca(OH)2]=0.0125mol,反应掉0.2mol,根据PCl3+3H2O→H3PO3+3HCl可知0.04molPCl3和水反应会生成0.04molH3PO3、0.12molHCl,需![]() Ca(OH)2,被氧化后生成Ca3(PO4)2的物质量为0.02mol;设PCl5为xmol,根据PCl5+4H2O→H3PO4+5HCl可知生成xmolH3PO4,5xmolHCl,需
Ca(OH)2,被氧化后生成Ca3(PO4)2的物质量为0.02mol;设PCl5为xmol,根据PCl5+4H2O→H3PO4+5HCl可知生成xmolH3PO4,5xmolHCl,需![]() Ca(OH)2,则4xmol=0.2mol-0.12mol,x=0.02mol,0.02mol PCl5溶于水最终转化为Ca3(PO4)2的物质的量为0.01mol,则Ca3(PO4)2的总物质的量为0.02mol+0.01mol=0.03mol,质量为0.03mol ×310g/mol=9.3g;
Ca(OH)2,则4xmol=0.2mol-0.12mol,x=0.02mol,0.02mol PCl5溶于水最终转化为Ca3(PO4)2的物质的量为0.01mol,则Ca3(PO4)2的总物质的量为0.02mol+0.01mol=0.03mol,质量为0.03mol ×310g/mol=9.3g;
(2)滤液中溶质为过量的Ca(OH)2和反应生成的CaCl2,过量n[Ca(OH)2]=0.0125mol,c[Ca(OH)2]=![]() =0.005mol/L,反应生成的n(CaCl2)=0.2125mol-0.125mol-0.03mol×3=0.11mol,所以c[CaCl2]=
=0.005mol/L,反应生成的n(CaCl2)=0.2125mol-0.125mol-0.03mol×3=0.11mol,所以c[CaCl2]=![]() =0.044mol/L。
=0.044mol/L。