题目内容
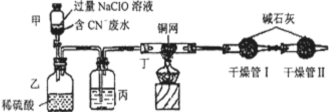
Ⅰ.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。

(1)在焙烧过程产生的尾气中,有一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列装置可行的是_________(填字母)。

(2)步骤②酸浸过程中,需要用到3mol·L-1,的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________________________;
(3)步骤④中,加入的X物质可以是________,作用是_____________。
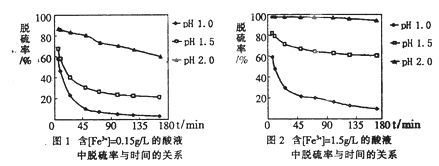
Ⅱ.已知FeSO4在高温下分解生成Fe2O3、SO3和SO2用下图所示装置设计实验,检验FeSO4在高温下分解生成的气态物质,并测定已分解的FeSO4质量.

已知:B装置、烧瓶E中所加试剂依次为氢氧化钠溶液、水(滴有数滴BaCl2溶液),请回答下列问题:
(1)D装置中所加试剂名称_____________________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:c→_______________→e。
(3)检验后,用烧瓶E中混合物测定已分解的FeSO4质量,此实验操作的第一步:_______________________________________________________;第二步:过滤混合物,在过滤器上将沉淀洗净后,灼烧并冷却至室温,称量其质量为ag,再次灼烧冷却至室温称量其质量为bg,且b<a,继续灼烧、冷却并称重,直到连续两次称量的质量差不超过0.1g为止。
(4)若最终得到沉淀cg,则已经分解的FeSO4质量________________(填计算式)。

(1)在焙烧过程产生的尾气中,有一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列装置可行的是_________(填字母)。

(2)步骤②酸浸过程中,需要用到3mol·L-1,的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________________________;
(3)步骤④中,加入的X物质可以是________,作用是_____________。
Ⅱ.已知FeSO4在高温下分解生成Fe2O3、SO3和SO2用下图所示装置设计实验,检验FeSO4在高温下分解生成的气态物质,并测定已分解的FeSO4质量.

已知:B装置、烧瓶E中所加试剂依次为氢氧化钠溶液、水(滴有数滴BaCl2溶液),请回答下列问题:
(1)D装置中所加试剂名称_____________________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:c→_______________→e。
(3)检验后,用烧瓶E中混合物测定已分解的FeSO4质量,此实验操作的第一步:_______________________________________________________;第二步:过滤混合物,在过滤器上将沉淀洗净后,灼烧并冷却至室温,称量其质量为ag,再次灼烧冷却至室温称量其质量为bg,且b<a,继续灼烧、冷却并称重,直到连续两次称量的质量差不超过0.1g为止。
(4)若最终得到沉淀cg,则已经分解的FeSO4质量________________(填计算式)。
(14分)
Ⅰ. (1)AB(2分)
(2)量筒、100mL容量瓶(2分)
(3) CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3等合理答案](2分);
调节溶液的pH,除去Fe3+(1分)
Ⅱ. (1)品红溶液(1分)
(2)abfgd(2分)
(3)向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止。(2分)
(4) c×152×2/233g(2分)
Ⅰ. (1)AB(2分)
(2)量筒、100mL容量瓶(2分)
(3) CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3等合理答案](2分);
调节溶液的pH,除去Fe3+(1分)
Ⅱ. (1)品红溶液(1分)
(2)abfgd(2分)
(3)向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止。(2分)
(4) c×152×2/233g(2分)
试题分析:
Ⅰ. (1)装置以碱液吸收处理尾气,并且要防止倒吸AB均可以,D中倒置漏斗伸入液面下过多,不能有效防倒吸(2) 配制该盐酸溶液时还要量筒、100mL容量瓶(3) 调节溶液的pH,除去Fe3+,但不能引入杂质离子,所以用CuO或Cu(OH)2、CuCO3、Cu2(OH)2CO3等合理答案;
Ⅱ. (1)检测二氧化硫一般用品红溶液,
(2)先进入C装置吸收SO3,在进入B装置吸收SO2,最后用品红溶液检测SO2是否完全吸收所以连接顺序为abfgd。
(3)为了测定硫酸钡的质量,应该使溶液中SO2- 4完全沉淀,所以向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止。
(4) 最终得到沉淀BaSO4cg,则n(BaSO4)=c/233mol,结合方程式 2FeSO4= Fe2O3+SO3+SO2、SO3+H2O+ BaCl2= BaSO4↓+HCl,可得关系式2FeSO4----- BaSO4,所以反应的FeSO4质量为c/233mol×2×152g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目