题目内容
下列有关化学用语表示正确的是( )。
A.CO2的电子式: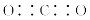
B.质子数为43、中子数为56的Tc原子:
C.Cl-的结构示意图:
D.氨基乙酸的结构简式:
D
【解析】A项应写成 ,A错误,B项应写成
,A错误,B项应写成 ,B错误;C项质子数为17,C错误。
,B错误;C项质子数为17,C错误。

T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前2 s 的平均速率v(CO)=0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(Cl2)=0.11 mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2 和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是______________(填编号);
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是__________________________________________,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:____________________________________;

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/10-12 m | 160 | 110 | 70 | 66 |
主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是( )。
A.离子半径:W<X
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y


