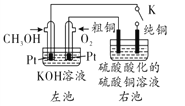
题目内容
【题目】向一体积不变的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件.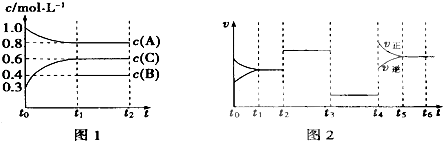
(1)若t1=15min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= .
(2)t3时改变的条件为 , B的起始物质的量为 .
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: .
【答案】
(1)0.02mol/(L?min)
(2)减小压强或取出部分平衡混合气体,1.0mol
(3)2A(g)+B(g)?3C(g)△H=+200aKJ/mol
【解析】解:(1)t0~t1阶段以c的浓度变化表示的反应速率v(C)= ![]() =
= ![]() mol/(L.min)=0.02mol/(L.min);
mol/(L.min)=0.02mol/(L.min);
(2)该反应的反应前后气体体积不变,t3时改变条件反应速率降低,平衡不移动,改变条件是减小压强,也可以取出部分平衡混合气体,其平衡不移动,且反应速率降低;
同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,则B的反应速率= ![]() =
= ![]() ×0.02mol/(L.min),反应开始时A的物质的量为2mol,其浓度为1.0mol/L,则容器体积为2L,
×0.02mol/(L.min),反应开始时A的物质的量为2mol,其浓度为1.0mol/L,则容器体积为2L,
参加反应的B的物质的量n=v△TV= ![]() =
= ![]() ×0.02mol/(L.min)×15min×2L=0.2mol,平衡时B的物质的量=0.4mol/L×2L=0.8mol,则B的物质的量=0.2mol+0.8mol=1.0mol;
×0.02mol/(L.min)×15min×2L=0.2mol,平衡时B的物质的量=0.4mol/L×2L=0.8mol,则B的物质的量=0.2mol+0.8mol=1.0mol;
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,则参加反应的A的物质的量为2mol时吸收热量为200kJ,其热化学反应方程式为2A(g)+B(g)3C(g)△H=+200a KJ/mol;
所以答案是:(1)0.02 mol/(Lmin);(2)减小压强或取出部分平衡混合气体;1.0mol;(3)2A(g)+B(g)3C(g)△H=+200a KJ/mol