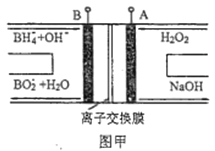
题目内容
【题目】单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si+4HCl。
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
【答案】D
【解析】
A.置换反应是一种单质和一种化合物生成另外一种单质和另外一种化合物,因此①③为置换反应,故A正确;
B.化合反应是两种或两种以上的物质生成一种物质的反应,因此②为化合反应,故B正确;
C.①②③中均有元素化合价的变化,均为氧化还原反应,故C正确;
D.①中Si的化合价由+4价→0价,化合价降低,被还原,②中Si的化合价由0价→+4价,化合价升高,被氧化,③中Si的化合价由+4价→0价,化合价降低,被还原,故D错误。
故选D。

【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
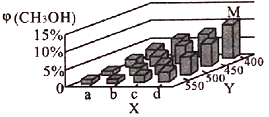
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
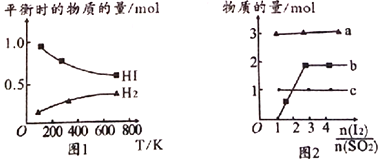
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。