题目内容
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
求:(1)该实验中所用稀硝酸的物质的量浓度;
(2)每一等份的混合物粉末中铜的质量。
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
(2)每一等份的混合物粉末中铜的质量。
(1)该实验中所用稀硝酸的物质的量浓度为4 .0mol/L;
(2)实验中每次所取混合物粉末中铜的质量为14.4g。(其它合理解法,同样给分)
试题分析:根据表中数据分析:实验1后剩余的17.2g固体只可能为Cu或Fe、Cu;实验5中金属完全反应,生成n(NO)=7.84L÷22.4L/mol=0.35mol,反应后溶液含有Fe(NO3)3、Cu(NO3)2和过量HNO3。
(1)假设实验1剩余的17.2g固体全部为Cu,实验1生成NO:n(NO)=2.24L÷22.4L/mol=0.1mol
由于实验2剩余8.0g固体,且比实验1多生成2.24LNO,即多生成0.1molNO则根据实验2多消耗的9.2g铜生成的NO小于0.1mol可知,假设实验1剩余的17.2g固体全部为Cu不成立。
所以实验1后剩余的17.2g固体只可能为Fe、Cu,实验1后溶液中只有Fe(NO3)2(2分)
2n (Fe参与反应)="3n(NO)=" 3×0.1mol
n (Fe参与反应)=0.15mol
每一份固体的质量为0.15mol×56g/mol+17.2g=25.6g
∴c(HNO3)=" 4n(NO)/0.1L=4.0mol/L"
(2)设每一份固体(25.6g)中含有的Fe、Cu物质的量分别为x、y
56x+64y="25.6g"
3x+2y=
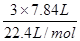
联立求解,解得x=0.2mol、y="0.225mol"
其中含铜:m(Cu)=" 0.225mol×64g/mol=14.4g"

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
