题目内容
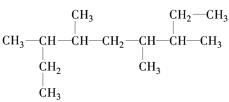
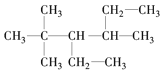
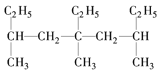
【题目】下列各表中的数字代表的时原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.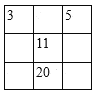 B.
B.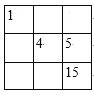
C.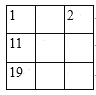 D.
D.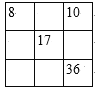
【答案】D
【解析】
在元素周期表中,相邻两个周期同主族元素的原子序数相差2、8、18、36,碱金属元素位于元素周期表的最左边,稀有气体位于最右边,据此对各选项进行判断。
A.根据元素周期表可知,3号和11号元素应该位于同一主族,11号元素的上面是3号元素,故A错误;
B.4和5号元素,12和13号元素间都有10个空列,为7个副族和1个Ⅷ族,不可能相邻,故B错误;
C.1号和11号元素之间相隔一个周期,第一列应为1、3、11、19,故C错误;
D.根据元素周期表可知,8号和9号相邻,9号下面是17号,17号下面是35号,35号和36号相邻,故D正确;
答案选D。

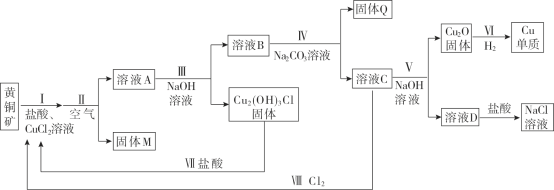
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离会减小环境污染,同时制得ZnSO4·7H2O实现资源的再利用,其流程图如下。已知FeAsO4难溶于水和酸;ZnSO4·7H2O易溶于水,难溶于酒精。
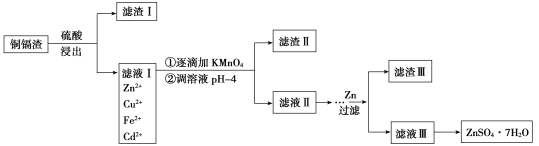
常温下金属离子沉淀的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出速率可以采用的方法是(写出其中一点即可)________。
(2)滤液Ⅰ中有少量AsO33—,若不除去,则AsO33—与Cd反应会产生一种有毒氢化物气体,其分子式为____,向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO33—反应生成FeAsO4,完成并配平下列反应的离子方程式___:Fe2++AsO33—+MnO4—+___=FeAsO4↓+Mn2++__,判断该滴定终点的现象是__________。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的成分为________。
(4)常温下Zn(OH)2的溶度积Ksp=________。
(5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时可选用试剂为________。