题目内容
下列判断正确的是
- A.酸性溶液中Fe3+、Al3+、
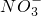 能大量共存
能大量共存 - B.AlCl3溶液蒸干后得到的固体是AlCl3
- C.在0.1mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
- D.pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7
AC
分析:A.酸性条件下如离子之间不发生任何反应则可大量共存;
B.AlCl3在加热时促进水解生成Al(OH)3;
C.从溶液质子守恒的角度分析;
D.醋酸为弱电解质,不能完全电离,pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合,溶液呈酸性.
解答:A.酸性溶液中Fe3+、Al3+、NO3-离子之间不发生任何反应,可大量共存,故A正确;
B.AlCl3在加热时促进水解生成Al(OH)3,加热蒸干不能得到AlCl3,故B错误;
C.在0.1mol/L CH3COONa溶液中存在质子守恒,即c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.醋酸为弱电解质,不能完全电离,pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合,醋酸过量,溶液呈酸性,故D错误.
故选AC.
点评:本题考查离子共离子浓度比较等知识,题目难度中等,注意溶液中的质子守恒的应用.
分析:A.酸性条件下如离子之间不发生任何反应则可大量共存;
B.AlCl3在加热时促进水解生成Al(OH)3;
C.从溶液质子守恒的角度分析;
D.醋酸为弱电解质,不能完全电离,pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合,溶液呈酸性.
解答:A.酸性溶液中Fe3+、Al3+、NO3-离子之间不发生任何反应,可大量共存,故A正确;
B.AlCl3在加热时促进水解生成Al(OH)3,加热蒸干不能得到AlCl3,故B错误;
C.在0.1mol/L CH3COONa溶液中存在质子守恒,即c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.醋酸为弱电解质,不能完全电离,pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合,醋酸过量,溶液呈酸性,故D错误.
故选AC.
点评:本题考查离子共离子浓度比较等知识,题目难度中等,注意溶液中的质子守恒的应用.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
 2B(g)和2A(g)
2B(g)和2A(g)