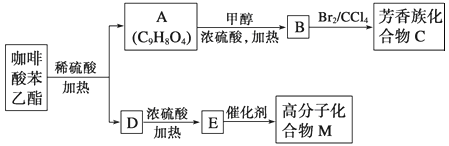
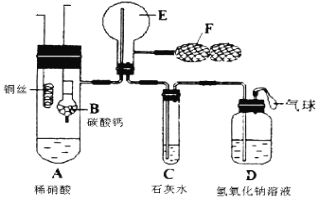
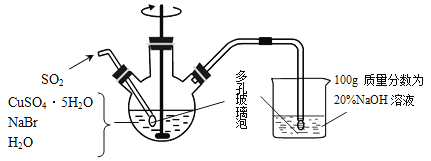
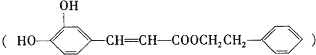题目内容
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
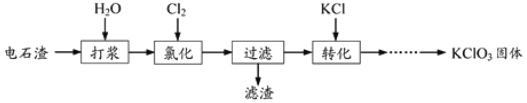
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
① 生成Ca(ClO)2的化学方程式为 。
② 提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
① 滤渣的主要成分为 (填化学式)。
② 滤液中Ca(ClO3)2与CaCl2物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
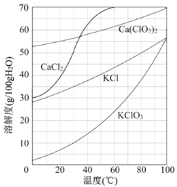
【答案】(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB;(2)①CaCO3、Ca(OH)2 ; ②<;(3)蒸发浓缩、冷却结晶。
【解析】
试题分析:(1)次氯酸钙是有氯气和氢氧化钙反应制备,氯气自身发生氧化还原反应,其反应方程式为2Cl2+2Ca(OH)2=Ca(ClO2)2+CaCl2+2H2O;②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2的速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解浓度过稀,对后续实验不利,因此AB正确;(2)①电石渣的成分是Ca(OH)2、CaCO3,根据流程图,CaCO3不参与反应,且CaCO3属于难溶物,则滤渣中含有CaCO3,Ca(OH)2微溶于水,滤渣中也含有Ca(OH)2;②根据信息,少量的Ca(ClO3)分解,因此两者的物质的量比值<1:5;(3)根据溶解度和温度的图像,KClO3溶解度受温度的影响较大,蒸发浓缩,达到饱和溶液,然后冷却结晶。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案