题目内容
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时发生的反应为:


下列关于该电池叙述错误的是
A. 电池中镀Pt导电玻璃为正极
B. 电池工作时,I-离子在镀Pt导电玻璃电极上放电
C. 电池工作时,电解质中I-和I3-浓度不会减少
D. 电池工作时,是将太阳能转化为电能
【答案】B
【解析】
由图电子的移动方向可知,透明导电玻璃电极为原电池的负极,镀Pt导电玻璃电极为原电池的正极,电解质为I3-和I-的混合物,I3-在正极上得电子被还原,正极反应为I3-+2e-=3I-,据此分析解答。
A.由图电子的移动方向可知,电极镀Pt导电玻璃为原电池的正极,选项A正确;
B.镀Pt导电玻璃电极为电池的正极,发生的反应为:I3-+2e-=3I-,选项B错误;
C.由电池中发生的反应可知,I3-在正极上得电子被还原为3I-,后又被氧化为I3-,I3-和I-相互转化,反应的实质是光敏有机物在激发态与基态的相互转化,所有化学物质都没有被损耗,选项C正确;
D.电池工作时,光能转变为电能,选项D正确。
答案选B。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的腐蚀液。
① 腐蚀过程中的离子方程式为______。
![]()
② 腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
i. 步骤I所加试剂和操作分别为______。
ii. 可实现步骤II转化的物质或方法是______(填一种即可)。
(2)研究发现,CuCl2溶液添加盐酸或氨水配制成酸性腐蚀液或碱性腐蚀液,其效果优于FeCl3溶液。腐蚀液的主要成分及腐蚀原理如下:
腐蚀液类型 | 主要成分 | 腐蚀原理 |
酸性腐蚀液 | Cu2+、H+、Cl- | Cu+ Cu2++2Cl- CuCl+2Cl- |
碱性腐蚀液 | Cu(NH3)42+、NH4+、NH3、Cl- | Cu(NH3)42++ Cu === 2Cu(NH3)2+ |

①酸性腐蚀液中铜离子含量对腐蚀速率的影响如右图所示,为保持较快和较平稳的腐蚀速率,腐蚀液中铜离子含量应选择______ g/100mL的使用范围。
②酸性腐蚀废液经过处理后,倒入一定量的水中,可得CuCl沉淀,过滤、洗涤、干燥后即得产品CuCl。倒入一定量的水中,可得CuCl沉淀的原因是_______。
③ 通入适量的氧气可使碱性腐蚀液再生。将该过程的离子方程式补充完整:______________
![]()
(3)H2O2也常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。回收其废液的工艺如下:


① 酸性条件下H2O2腐蚀金属铜的离子方程式为______。
② 右图是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因______。
③ 碱转时的反应为:Cu2(OH)3Cl+NaOH =CuO+Cu(OH)2+NaCl+H2O。检验转化完全的方法是:取少量洗涤后的碱转固体,_______。
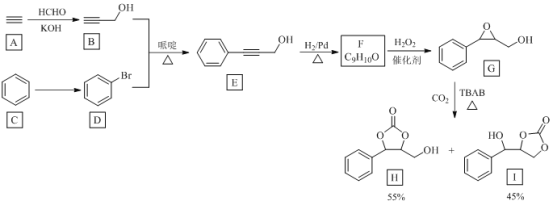
【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。