题目内容
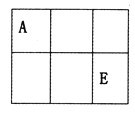
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
(1)C在元素周期表中的位置为________,其离子的结构示意图为________________。
(2)AE2的分子式为______________。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________(填离子符号)。
(5)实验室制取F2气体的离子方程式为____________。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_____________________。
【答案】(1)第二周期第ⅥA族![]()
(2)CS2(3)O2 (4)S2->Cl>O2->Al3+
(5)MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(6)2NH3H2O+3H2O2=N2↑+8H2O
【解析】试题分析:由题中所给信息可知,A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A能与氧元素形成两种无色气体,则A为C元素;C为O元素;D为Al元素,且图中给出了A和E在元素周期表中的相对位置,则B为N;E是S;F为Cl
(1)C为氧元素,在周期表中的位置为第二周期第ⅥA族;其离子结构示意图为![]() ;
;
(2)A为C,E为S,因此AE2的分子式为CS2
(3)由题元素的非金属性越强,其单质的沸点越低,氧,硫,氯中,非金属性:O>Cl>S,因此O2的沸点最低。
(4)具有相同的电子层结构的离子,核电荷数越大,原子核对核外电子的吸引能力越强,离子半径越小。具有不同电子层结构的离子,电子层数越多,离子半径越大。因此可得离子半径:S2->Cl>O2->Al3+
(5)实验室制取氯气使用二氧化锰和盐酸反应生成氯气,其离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
(6)B为N,其最简单的气态氢化物为NH3,反应方程式为NH3H2O+3H2O2=N2↑+8H2O

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案