题目内容
【题目】下列物质中,不能使有色布条褪色的是( )
A. 次氯酸钠溶液 B. 次氯酸钙溶液
C. 氯水 D. 氯化钙
【答案】D
【解析】A.次氯酸钠溶液含有ClO-,能生成HClO,具有漂白性,故A不选; B. 次氯酸钙溶液含有ClO-,能生成HClO,具有漂白性,故B不选;C.氯水中含有HClO,具有漂白性,故C不选;D.氯化钙溶液不具有漂白性,故D选;故选D。

【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:


请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
【题目】闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。软锰矿的主要成分为 MnO2;含少量A12O3和SiO2。现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如下(中间产物的固体部分已经略去)。

已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式________________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_______________。
(3)步骤③与MnO2发生氧化还原反应的离子方程式_________________,物质X可以是__________(用字母表示。
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是____________(填化学式)。
(5)MnO2与Li构成LiMnO2,该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:

①外电路中的电子移动方向是由______极流向______极(填字母)。
②写出该锂离子电池的正极电极反应式_____________________________。
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7 ,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为______________________。
【题目】某化学兴趣小组的同学们对SO2的有关反应进行实验探究:
【实验I】探究SO2催化氧化的反应:

(1)装置 A模拟工业生产中SO2催化氧化的反应,其化学方程式是_________________________。〇
(2)为检验反应后的气体成分,将上图装置依次连接的合理顺序为A、(按气流方向,用字母表示)_______。
(3)能证明气体中有SO2的实验现象是_____________,有SO3的实验现象是_____________。
【实验II】探究SO2与Fe(NO3)3,溶液的反应:
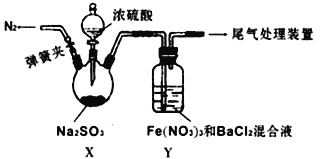
(4)X中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 ___________________________。
(5)装置Y中产生了白色沉淀,其成分是_________;该研究小组对产生白色沉淀的原因进行了假设:
假设1:在酸性条件下SO2与NO3-反应;
假设2:SO2与Fe3+反应;
假设3:___________________________。
(6)某同学设计实验验证假设1,请帮他完成下表中内容。
实验步骤 | 现象和结论 |
①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的________,并通入适量N2; ③将SO2通入步骤②中溶液。 | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立。 |
经验证假设1成立,则验证过程中发生反应的离子方程式是_______________(提示:此条件下未见气体产生)。
【题目】(l)将Cl2通入水中,Cl2部分与水反应:Cl2+H2O=H++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量________。
a.AgNO3晶体 b. CaCO3粉末 c. NaCl晶体 d.蒸馏水 e.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO +H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
a.反应开始时,正反应速率大于逆反应速率
b.反应开始时,正反应速率最大,逆反应速率为零
c.随着反应的进行,正反应速率逐渐减小,最后为零
d.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等。
(3)一定条件下(温度值定), SO2与O2反应的浓度随时间的变化如下表
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)mol/L | 1.0 | |||||||
c(O2)mol/L | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
C(SO3)mol/L | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
a.30min-40min 时间段,以SO2表示的反应速率为__________;
b.该温度下,正反应的平衡常数的值为__________________;
c.平衡时,SO2的转化率为_______;
(4)电解尿素[CO(NH3)2]的碱性溶液制氢气的装置示意图见下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为____________。

(5)3.04g铜镁合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是_________mL。