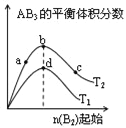
ЬтФПФкШн
ЁОЬтФПЁПвбжЊH2O2ЁЂKMnO4ЁЂNaClOЁЂK2Cr2O7ОљОпгаЧПбѕЛЏадЁЃНЋШмвКжаЕФCu2ЃЋЁЂFe2ЃЋЁЂFe3ЃЋГСЕэЮЊЧтбѕЛЏЮяЃЌашШмвКЕФpHЗжБ№ЮЊ6.4ЁЂ9.6ЁЂ3.7ЁЃЯжгаКЌFeCl2дгжЪЕФТШЛЏЭОЇЬх(CuCl2ЁЄ2H2O)ЃЌЮЊжЦШЁДПОЛЕФCuCl2ЁЄ2H2OЃЌЪзЯШНЋЦфжЦГЩЫЎШмвКЃЌШЛКѓАДЭМЪОВНжшНјааЬсДПЃК
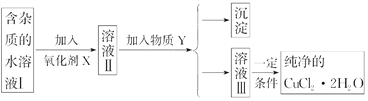
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)БОЪЕбщзюЪЪКЯЕФбѕЛЏМСXЪЧ________(ЬюађКХ)ЁЃ
AЃЎK2Cr2O7ЁЁЁЁЁЁЁЁЁЁЁЁЁЁ BЃЎNaClO
CЃЎH2O2 DЃЎKMnO4
(2)ЮяжЪYЪЧ________ЁЃ
(3)Г§ШЅFe3ЃЋЕФгаЙиРызгЗНГЬЪНЪЧ____________________ЁЂ_______________________ЁЃ
(4)МгбѕЛЏМСЕФФПЕФЪЧ____________________________________________ЁЃ
(5)зюКѓФмВЛФмжБНгеєЗЂНсОЇЕУЕНCuCl2ЁЄ2H2OОЇЬхЃП________ЃЌгІШчКЮВйзїЃП_____ЁЃ
ЁОД№АИЁП C CuO[ЛђCu(OH)2ЛђCuCO3ЛђCu2(OH)2CO3] Fe3ЃЋЃЋ3H2O![]() Fe(OH)3ЃЋ3HЃЋ CuOЃЋ2HЃЋ===Cu2ЃЋЃЋH2O[ЛђCu(OH)2ЃЋ2HЃЋ===Cu2ЃЋЃЋ2H2OЕШ] НЋFe2ЃЋбѕЛЏЮЊFe3ЃЋЃЌБугкЩњГЩГСЕэЖјгыCu2ЃЋЗжРы ВЛФм гІдкHClЦјСїжаМгШШеєЗЂ
Fe(OH)3ЃЋ3HЃЋ CuOЃЋ2HЃЋ===Cu2ЃЋЃЋH2O[ЛђCu(OH)2ЃЋ2HЃЋ===Cu2ЃЋЃЋ2H2OЕШ] НЋFe2ЃЋбѕЛЏЮЊFe3ЃЋЃЌБугкЩњГЩГСЕэЖјгыCu2ЃЋЗжРы ВЛФм гІдкHClЦјСїжаМгШШеєЗЂ
ЁОНтЮіЁП(1)МгШыбѕЛЏМСЕФФПЕФЪЧНЋFe2+бѕЛЏЮЊFe3+ЃЌЕЋВЛФмДјШыаТЕФдгжЪЃЌЙЪзюКУЕФбѕЛЏМСЪЧH2O2ЃЌH2O2БЛЛЙдКѓЩњГЩH2OЃЌУЛгаДјШыаТЕФдгжЪЃЌЖјK2Cr2O7ЁЂNaClOЁЂKMnO4ЖМЛсДјШыаТЕФдгжЪЃЌЙЪД№АИбЁCЁЃ
(2)ШмвКЂђжаЕФШмжЪЮЊFeCl3КЭCuCl2ЃЌСНепЫЎНтЪЙШмвКГЪШѕЫсадЃЌвЊЪЙFe3+ГСЕэЖјCu2+ВЛГСЕэЃЌИљОнСНжжРызгГСЕэЕФpHВЛЭЌЃЌПЩвдЯђШмвКжаМгШыЙЬЬхCuO[ЛђCu(OH)2ЛђCuCO3ЛђCu2(OH)2CO3]ЕїНкШмвКЕФЫсМюЖШЃЌЪЙШмвКЕФpH=3.7ЃЌДЫЪБFe3+ГСЕэЖјCu2+ЮДГСЕэЃЌЭЌЪБвВВЛЛсДјШыаТЕФдгжЪЃЌЙЪД№АИЮЊМгШыCuO[ЛђCu(OH)2ЛђCuCO3ЛђCu2(OH)2CO3]ЁЃ
(3)Fe3+ЗЂЩњЫЎНтЗДгІЃКFe3ЃЋЃЋ3H2O![]() Fe(OH)3ЃЋ3HЃЋЃЌМгШыЕФCuOЛђCu(OH)2гыЫЎНтЕУЕНЕФH+ЗДгІЃЌДйЪЙЫЎНтЦНКте§ЯђвЦЖЏЃЌзюжеFe3+ШЋВПзЊЛЏЮЊFe(OH)3ГСЕэЃЌРызгЗНГЬЪНЮЊЃКCuOЃЋ2HЃЋ===Cu2ЃЋЃЋH2O[ЛђCu(OH)2ЃЋ2HЃЋ===Cu2ЃЋЃЋ2H2OЕШ]ЁЃ
Fe(OH)3ЃЋ3HЃЋЃЌМгШыЕФCuOЛђCu(OH)2гыЫЎНтЕУЕНЕФH+ЗДгІЃЌДйЪЙЫЎНтЦНКте§ЯђвЦЖЏЃЌзюжеFe3+ШЋВПзЊЛЏЮЊFe(OH)3ГСЕэЃЌРызгЗНГЬЪНЮЊЃКCuOЃЋ2HЃЋ===Cu2ЃЋЃЋH2O[ЛђCu(OH)2ЃЋ2HЃЋ===Cu2ЃЋЃЋ2H2OЕШ]ЁЃ
(4)МгбѕЛЏМСЕФФПЕФЪЧНЋFe2+бѕЛЏЮЊFe3+ЃЌдкНЯЕЭЕФpHЯТПЩвдЪЙFe3+ГСЕэЖјгыCu2+ ЗжРыЃЌШєВЛбѕЛЏFe2+ ЃЌFe2+ГСЕэЪБЕФpHЮЊ9.6ЃЌетИіpHЬѕМўЯТCu2+вВЛсГСЕэЃЌЮоЗЈЗжРыГіCu2+ЃЌЙЪД№АИЮЊЃКНЋFe2ЃЋбѕЛЏЮЊFe3ЃЋЃЌБугкЩњГЩГСЕэЖјгыCu2ЃЋЗжРыЁЃ
(5) CuCl2взЗЂЩњЫЎНтЃКCuCl2+2H2O![]() Cu(OH)2+2HClЃЌЫЎНтЗДгІЮЊЮќШШЗДгІЃЌжБНгМгШШеєЗЂНсОЇЃЌЦНКте§ЯђвЦЖЏЃЌЧвHClШнвзЛгЗЂЃЌвВДйЪЙЦНКте§ЯђвЦЖЏЃЌзюжеЩњГЩЕФЪЧCu(OH)2ГСЕэЖјВЛЪЧCuCl2ЁЄ2H2OОЇЬхЃЌвђДЫБиаывжжЦCu2+ЕФЫЎНтЃЌГжајЭЈШыHClЦјЬхПЩдіДѓЩњГЩЮяЕФХЈЖШЃЌЪЙЦНКтФцЯђвЦЖЏЃЌДгЖјвжжЦCu2+ЕФЫЎНтЁЃЙЪД№АИЮЊЃКВЛФмЁЂгІдкHClЦјСїжаМгШШеєЗЂЁЃ
Cu(OH)2+2HClЃЌЫЎНтЗДгІЮЊЮќШШЗДгІЃЌжБНгМгШШеєЗЂНсОЇЃЌЦНКте§ЯђвЦЖЏЃЌЧвHClШнвзЛгЗЂЃЌвВДйЪЙЦНКте§ЯђвЦЖЏЃЌзюжеЩњГЩЕФЪЧCu(OH)2ГСЕэЖјВЛЪЧCuCl2ЁЄ2H2OОЇЬхЃЌвђДЫБиаывжжЦCu2+ЕФЫЎНтЃЌГжајЭЈШыHClЦјЬхПЩдіДѓЩњГЩЮяЕФХЈЖШЃЌЪЙЦНКтФцЯђвЦЖЏЃЌДгЖјвжжЦCu2+ЕФЫЎНтЁЃЙЪД№АИЮЊЃКВЛФмЁЂгІдкHClЦјСїжаМгШШеєЗЂЁЃ

 зДдЊЗЛШЋГЬЭЛЦЦЕМСЗВтЯЕСаД№АИ
зДдЊЗЛШЋГЬЭЛЦЦЕМСЗВтЯЕСаД№АИ