题目内容
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是( )
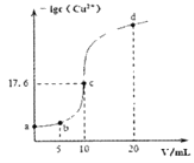
A. 常温下Ksp (CuS)的数量级为10-30
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
【答案】D
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,图中-lgc(Cu2+)越大,则c(Cu2+)越小,结合图中浓度计算溶度积常数及溶液中的守恒思想分析解答。
A.根据图像,V=10mL时,二者恰好完全反应生成CuS沉淀,CuSCu2++S2-,平衡时c(Cu2+)=c(S2-)=10-17.6mol/L,则Ksp(CuS)=c(Cu2+)c(S2-)=10-17.6mol/L×10-17.6mol/L=10-35.2mol2/L2,Ksp(CuS)的数量级为10-36,故A错误;
B.c点为NaCl溶液,对水的电离无影响,而a点为氯化铜溶液、d点为硫化钠溶液,都会发生水解反应促进水的电离,则c点溶液中水的电离程度小于a点和d点溶液,故B错误;
C.根据图像,b点时钠离子的物质的量为0.1mol/L×0.005L×2=0.001mol,氯离子的物质的量为0.1mol/L×0.01L×2=0.002mol,则c(Cl-)=2c(Na+),故C错误;
D.d点溶液中NaCl和Na2S的浓度之比为2:1,且溶液显碱性,因此c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+),故D正确;
答案选D。