题目内容
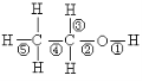
【题目】(1)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥蔗糖⑦澄清石灰水,其中属于电解质的有_____________,属于非电解质的有__________________(填编号)。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_____________(用化学式表示,后同),_____________元素被氧化,还原产物为_____________;
②当反应中有1molNaFeO4生成,转移的电子有_____________ mol;
③用单线桥法标出反应中电子转移的方向和数目。________
(3)配平该反应方程式:
______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________。
【答案】②③ ①⑥ NaC1O Fe NaCl 3 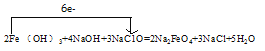 1 14 2 2 3 7 Cu+2Fe3+=Cu2++2Fe2+
1 14 2 2 3 7 Cu+2Fe3+=Cu2++2Fe2+
【解析】
(1)根据在水溶液或熔融状态下能导电的化合物为电解质,都不导电的化合物为非电解质进行分析,注意单质和混合物。
(2)根据反应中元素化合价的变化分析氧化剂和还原剂等。
(3)根据反应中的电子守恒和质量守恒分析配平反应。
(4). Cu+2Fe3+=Cu2++2Fe2+。
(1) ①二氧化碳是非电解质,②熔融KC1是电解质,③NaHSO4固体是电解质,④铜是单质,不是电解质也不是非电解质,⑤稀硫酸是溶液,属于混合物,不是电解质也不是非电解质,⑥蔗糖是非电解质,⑦澄清石灰水是溶液,是混合物,不是电解质也不是非电解质。
(2) ① 2Fe(OH)3+4NaOH+3NaC1O=2Na2FeO4+3NaCl+5H2O反应中,次氯酸钠中的氯元素化合价降低,做氧化剂,还原产物为氯化钠,氢氧化铁中的铁元素化合价升高,做还原剂,被氧化。
②该反应中转移6个电子,所以当反应中有1molNaFeO4生成,转移3mol电子。
③该反应的单线桥为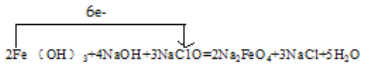
(3) ______K2Cr2O7+______HCl═______KCl+______CrCl3+______Cl2↑+______H2O,铬元素化合价从+6降低到+3,氯元素化合价从-1升高到0,根据电子守恒和质量守恒得到方程式为K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O。
(4)铜和氯化铁反应生成氯化铜和氯化亚铁,离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。

 阅读快车系列答案
阅读快车系列答案【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。