题目内容
9.用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )| A. | 0.5mol/L | B. | 1mol/L | C. | 2mol/L | D. | 4mol/L |
分析 用石墨电极电解100mL H2SO4与CuSO4的混合液,阳极上电极反应式为4OH--4e-=O2↑+2H2O、阴极反应式为Cu2++2e-=Cu、2H++2e-=H2↑,两极均收集到2.24L(标况)气体,则阴阳极上得到气体物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,串联电路中转移电子相等,根据转移电子相等计算铜离子的物质的量,再根据c=$\frac{n}{V}$计算铜离子物质的量浓度.
解答 解:用石墨电极电解100mL H2SO4与CuSO4的混合液,阳极上电极反应式为4OH--4e-=O2↑+2H2O、阴极反应式为Cu2++2e-=Cu、2H++2e-=H2↑,两极均收集到2.24L(标况)气体,则阴阳极上得到气体物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极上转移电子物质的量=4n(O2)=4×0.1mol=0.4mol,生成氢气转移电子物质的量=2n(H2)=2×0.1mol=0.2mol,串联电路中转移电子相等,根据转移电子相等得n(Cu2+)=$\frac{0.4mol-0.2mol}{2}$=0.1mol,c(Cu2+)=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L,故选B.
点评 本题以电解原理为载体考查物质的量的有关计算,侧重考查学生分析计算能力,利用转移电子守恒进行计算即可,知道每个电极上生成气体与转移电子之间的关系式,题目难度不大.

练习册系列答案
相关题目
20.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 4.48L F2变为离子时,获得的电子数为0.2NA | |
| B. | 16g甲烷所含的原子数为NA | |
| C. | 2molNa与足量的O2反应无论是生成Na2O还是Na2O2时电子转移数目为2NA | |
| D. | 18g重水(D2O)所含的电子数为10NA |
17.下列说法错误的是( )
| A. | 铍(Be)的原子失去电子能力比镁弱 | |
| B. | 砹(At)的氢化物不稳定 | |
| C. | 硫化氢比硒(Se)化氢稳定 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性弱 |
4.下列物质的不饱和溶液能通过加热蒸发的方法使之变成饱和溶液的是( )
| A. | NaBr | B. | Ca(HCO3)2 | C. | H2S |
1.在一定条件下MO3-与M-发生反应:MO3-+5M-+6H+═3M2+3H2O,则下列关于M元素的叙述中正确的是( )
| A. | M位于元素周期表的第VA族 | B. | M的氢化物的水溶液呈酸性 | ||
| C. | MO3-中的M元素只能被还原 | D. | M2在常温常压下一定是气体 |
18.向有机物X中加入合适的试剂(可以加热),检验其官能团.下列有关结论错误的是( )
| 选项 | 试剂 | 现象 | 结论 |
| A | 金属钠 | 有气体产生 | 含羟基或羧基或羟基、羧基 |
| B | 银氨溶液 | 产生银镜 | 含有醛基 |
| C | 碳酸氢钠溶液 | 产生气泡 | 含有羧基 |
| D | 溴水 | 溶液褪色 | 含有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.请根据下述路线,回答下列问题:
的物质,该物质是一种香料.请根据下述路线,回答下列问题:
 .
. .
.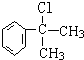 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. 等.
等.