题目内容
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是___ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S____(填“强”或“弱”)。气态SeO3分子的立体构型为____ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—而体现一元弱酸的性质,则[B(OH)4]—中B的原子杂化类型为 。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的离子方程式为 。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(已知lpm=10-12m,只要求列算式,不必计算出数值,阿伏加塞罗常数为NA)。
(15分)
⑴1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)(1分)
⑵Br>As>Se(2分)
⑶强(1分)平面三角形(1分)
⑷硅烷的相对分子质量越大,分子间范德华力越强(或其他合理答案)(2分)
⑸sp3(1分)
⑹H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行(2分)
Cu+H2O2+4NH3=Cu(NH3)42++2OH-(2分)
⑺1∶3(1分) (197+64×3)×1030/(a3NA)(其它合理答案均给分)(2分)
【解析】
试题分析:⑴31号元素镓的基态原子的电子排布式是1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
⑵一个周期从左往右第一电离能呈增大趋势,故硒、砷和溴元素的第一电离能从大到小顺序为Br>As>Se
⑶第ⅥA氢化物水溶液酸性由弱变强,故H2Se的酸性比H2S强。气态SeO3分子的立体构型为平面三角形。
⑷[B(OH)4]—中B的原子结合4个羟基,杂化类型为sp3。
⑸组成和结构相似的分子,相对分子质量越大,分子间范德华力越强,沸点越高。
⑹H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行;
Cu+H2O2+4NH3=Cu(NH3)42++2OH-。
⑺该铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,故平均1个晶胞中含8×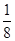 =1个Au原子,6×
=1个Au原子,6× =3个Au原子,故该合金中Au原子与Cu原子个数之比为1∶3。1个晶胞的质量为
=3个Au原子,故该合金中Au原子与Cu原子个数之比为1∶3。1个晶胞的质量为 g,体积为
g,体积为 ,合金的密度为
,合金的密度为 =(197+64×3)×1030/(a3NA)g·cm-3
=(197+64×3)×1030/(a3NA)g·cm-3

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案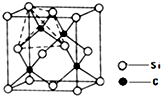 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质] (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.

