题目内容
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
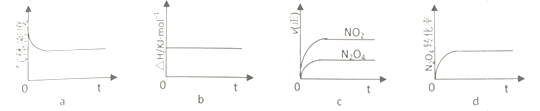
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
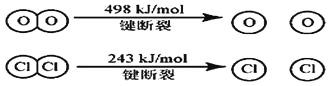
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
【答案】 变小 不 吸热 a、d 不变 4HCl(g)+O2(g)![]() 2Cl2 (g)+2H2O(g) △H=-115.6kJ/mol 31.9 强
2Cl2 (g)+2H2O(g) △H=-115.6kJ/mol 31.9 强
【解析】试题分析:本题考查影响化学反应速率和化学平衡的因素,化学平衡的标志,反应热的计算和热化学方程式的书写。
(1)保持容器内气体压强不变,向其中加入1molN2,容器体积变大,各物质的浓度减少,反应速率变小;由于该反应为气体分子数不变的反应,所以平衡不移动。
(2)①升高温度,气体颜色变深,平衡正向移动,ΔH![]() 0,反应为吸热反应。
0,反应为吸热反应。
②a项,该反应是所有物质全为气体且正反应分子数增大的反应,气体的质量始终不变,建立平衡过程中气体物质的量增大,恒温恒压条件下气体体积增大,气体密度减小,气体密度不变说明达到平衡状态;b项,ΔH=生成物的总能量-反应物的总能量,与化学计量数有关,与反应是否达到平衡无关;c项,正反应速率随着时间推移逐渐减小,达到平衡时保持不变,错误;d项,随着时间的推移N2O4的转化率逐渐增大,达到最大保持不变说明反应达到平衡状态;答案选a、d。
③化学平衡常数只与温度有关,温度不变,容器变化,平衡常数不变。
(3)①2mol HCl被氧化,放出 57.8kJ 的热量,则4mol HCl被氧化,放出 115.6kJ 的热量,反应的热化学方程式为4HCl(g)+O2(g)![]() 2Cl2 (g)+2H2O(g) △H=-115.6kJ/mol。
2Cl2 (g)+2H2O(g) △H=-115.6kJ/mol。
②由图示知,E(Cl-Cl)=243 kJ/mol,E(O=O)=498kJ/mol,ΔH=反应物的键能总和-生成物的键能总和=4E(H-Cl)+E(O=O)-[2E(Cl-Cl))+4E(H-O)]=- 115.6kJ/mol,E(H-O)-E(H-Cl)=31.9kJ/mol,H-O的键能比H-Cl的键能大,则H2O中H-O键比HCl中H-Cl键强。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下列表格中各项都正确的一组是( )
选项 | 类别 | |||
碱 | 盐 | 电解质 | 非电解质 | |
A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
B | 纯碱 | CaCO3 | NH3·H2O | Fe |
C | 明矾 | 食盐 | 石墨 | 蔗糖 |
D | KOH | CuSO4 | Na2SO4 | NaClO |
A.AB.BC.CD.D