题目内容
【题目】某研究性学习小组设计了图1置研究硝酸的性质.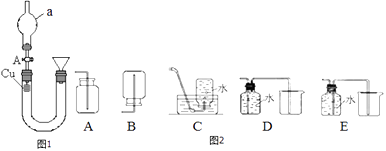
(1)实验一:甲组同学用图一装置来证实稀硝酸与铜反应生成NO.a.装置中a仪器的名称为 .
b.加入硝酸的操作:应先活塞A,然后从右管的漏斗中向U形管中逐渐注入稀硝酸.当注满后,应活塞A,此时观察到的现象 . 待反应一会后若打开活塞A,观察到的现象为 .
c.若要收集NO气体,如图2收集装置中合适的是(填序号) .
d.在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L、0.1mol/L向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是 .
(2)实验二:乙组同学利用上述装置完成浓硝酸与铜的反应a.乙组同学发现实验室里有几瓶浓硝酸呈黄色,请用简单的文字和方程式解释这种现象 .
b.同学们发现浓硝酸与铜反应后的溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了NO2气体所致.同学们分别设计了以下3个实验来判断两种看法是否正确.这些方案中可行的是 . (填序号,多选不给分)
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化.
【答案】
(1)球形干燥管;打开;关闭;U型管左管中,铜表面有无色气体生成,液面下降,溶液逐渐变为蓝色;在干燥管中看到气体变为红棕色,左管液面上升;C、E;0.225mol/L
(2)浓硝酸受热或见光易分解产生红棕色的二氧化氮气体(4HNO3 ![]() 4NO2↑+O2↑+2H2O),该气体溶于浓硝酸中,而使溶液变为黄色;①③
4NO2↑+O2↑+2H2O),该气体溶于浓硝酸中,而使溶液变为黄色;①③
【解析】解:(1)a.装置中a仪器含有典型的球泡特征,为球形干燥管,所以答案是:球形干燥管;b.加入硝酸的操作:应先打开活塞A保证U形管内压强平衡,同时把U形管左侧的空气排出,铜丝和硝酸反应,所以当注满后,应关闭活塞A,铜和稀硝酸反应生成硝酸铜和无色气体一氧化氮,硝酸铜为蓝色,所以此时观察到的现象为U型管左管中,铜表面有无色气体生成,液面下降,溶液逐渐变为蓝色,待反应一会后若打开活塞A,空气进入,在干燥管中无色的一氧化氮被氧化成红棕色的二氧化氮,左管液面上升,所以答案是:打开;关闭;U型管左管中,铜表面有无色气体生成,液面下降,溶液逐渐变为蓝色;在干燥管中看到气体变为红棕色,左管液面上升;c.一氧化氮有毒且易和氧气反应生成二氧化氮,一氧化氮不和水反应,所以不能用排水法收集,应该用排水法收集,排水装置中,气体的进出口符合“短进长出”的原则,故CE符合,所以答案是:C、E;d.1.92g的铜的物质的量n(Cu)= ![]() =0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3﹣)=0.4mol/L×0.1L=0.04mol,由3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O可知,Cu与NO3﹣过量,H+不足,氢离子的物质的量进行计算,设产生的铜离子的物质的量为x moL, 3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3﹣)=0.4mol/L×0.1L=0.04mol,由3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O可知,Cu与NO3﹣过量,H+不足,氢离子的物质的量进行计算,设产生的铜离子的物质的量为x moL, 3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
8 3
0.06 x ![]() =
= ![]() ,x=0.0225mol,
,x=0.0225mol,
c(Cu2+)= ![]() =0.225mol/L,
=0.225mol/L,
所以答案是:0.225mol/L;(2)a.浓硝酸不稳定,受热或见光分解产生的红棕色二氧化氮溶解其中呈黄色,反应方程式为4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O,所以答案是:浓硝酸受热或见光易分解产生红棕色的二氧化氮气体(4HNO3
4NO2↑+O2↑+2H2O,所以答案是:浓硝酸受热或见光易分解产生红棕色的二氧化氮气体(4HNO3 ![]() 4NO2↑+O2↑+2H2O),该气体溶于浓硝酸中,而使溶液变为黄色;b.加热绿色溶液,气体的溶解量减小,能改变溶液中溶解气体的量,故①正确,而加水稀释绿色溶液,由于溶液浓度变小,溶液的颜色会变化,而且加水后气体的溶解量加大,溶液的颜色也会发生变化,故不能进行判断,故②错误,向该绿色溶液中通入氮气,氮气难溶于水,通入氮气可以带走二氧化氮气体,由于溶液浓度变小,溶液的颜色会变化,可以证明该溶液中是否为溶解了NO2气体所致,故③正确,
4NO2↑+O2↑+2H2O),该气体溶于浓硝酸中,而使溶液变为黄色;b.加热绿色溶液,气体的溶解量减小,能改变溶液中溶解气体的量,故①正确,而加水稀释绿色溶液,由于溶液浓度变小,溶液的颜色会变化,而且加水后气体的溶解量加大,溶液的颜色也会发生变化,故不能进行判断,故②错误,向该绿色溶液中通入氮气,氮气难溶于水,通入氮气可以带走二氧化氮气体,由于溶液浓度变小,溶液的颜色会变化,可以证明该溶液中是否为溶解了NO2气体所致,故③正确,
所以答案是:①③.




