题目内容
【题目】下列各组离子能在溶液中大量共存的是
A. Na+、Fe3+、SO42-、I- B. H+、Fe2+、SO42-、NO3-
C. K+、NH4+、CO32-、OH- D. Ca2+、Al3+、NO3-、Cl-
【答案】D
【解析】A. 在溶液中Fe3+与I-发生氧化还原反应,不能大量共存,A错误;B. H+、Fe2+、NO3-在溶液中发生氧化还原反应,不能大量共存,B错误;C. 在溶液中NH4+与OH-反应生成一水合氨,不能大量共存,C错误;D. Ca2+、Al3+、NO3-、Cl-在溶液中不反应,能大量共存,D正确,答案选D。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
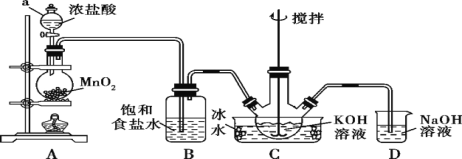
名校作业本系列答案【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)上述反应中氧化剂和还原剂物质的量之比是______ ,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为______ 。
(2)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:__________________ .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且![]() 值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。