��Ŀ����
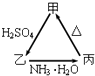
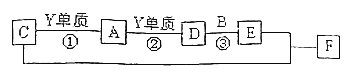
����Ŀ����A��B��C��D��E��F����ǰ�����ڵ�Ԫ�أ�ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�D��FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������Aԭ�Ӻ���ֻ��һ�����ӣ�Ԫ��A��B�γɵ���̬���������10e�����ռ乹��Ϊ�����Σ�CԪ��ԭ�ӵ�����������������Ӳ�����3����C��Eͬ���壮ͼ�о���D��FԪ�ص����ʾ�����ͼʾת����ϵ�� 
�پ���DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ��
�ھ���FԪ�ص��ң����ʣ��������������ת��ȫΪ������ԭ��Ӧ����ش��������⣺
��1��������ĵ���ʽΪ ��
��2��FԪ�������ڱ��е�λ���ȶ��ԣ�A2CA2E������ڡ���С�ڡ������ڡ�����
��3��������DԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽ
��4���������ֱ��Ǻ�FԪ�صļ������ӣ����麬�������������ӵĻ����Һ�еĵͼ����ӣ�����������KMnO4��Һ�����Ӧ�����ӷ���ʽΪ��
��5����֪�����»�����FE��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2E��Һ�뺬FSO4��Һ�������3��2��ϣ����г���F E���ɣ��������FSO4��Ũ��Ҫ�� �� �����Ի�Ϻ���Һ������仯����
���𰸡�
��1��![]()
��2���������ڵڢ��壻����
��3��Al3++3AlO2��+6H2O=4Al��OH��3��
��4��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O
��5�����ڻ����2.5��10��12mol/L
���������⣺A��B��C��D��E��F����ǰ�����ڵ�Ԫ�أ�ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�D��FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������AԪ��ԭ�Ӻ���ֻ��һ�����ӣ���AΪHԪ�أ�CԪ��ԭ�ӵ�����������������Ӳ�����3������Cԭ�Ӻ�����2�����Ӳ㣬����������Ϊ6����CΪO��Ԫ�أ�E��Cͬ���壬��EΪSԪ�أ�Ԫ��A��B�γɵ���̬���������10e�����ռ乹��Ϊ�����Σ���BΪNԪ�أ���ΪNH3�� D��FΪ��������Ԫ�أ�������DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ��DΪAlԪ�أ����ΪAl��OH��3 �� �ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣�������FԪ�ص��ҡ������������ת��ȫΪ������ԭ��Ӧ��FԪ��Ϊ��������Ԫ�أ���FΪFeԪ�أ���ΪFe���ʡ���ΪFe2+����ΪFe3+ �� ��1���������ΪNH3 �� �����ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��FΪFeԪ�أ�λ�����ڱ��е������ڵڢ��壻�ǽ�����O��S�����⻯���ȶ���H2O����H2S�����Դ��ǣ��������ڵڢ��壻���ڣ���3���ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣����߷�Ӧ���ӷ���ʽΪ��Al3++3AlO2��+6H2O=4Al��OH��3�������Դ��ǣ�Al3++3AlO2��+6H2O=4Al��OH��3������4���������Ӿ��л�ԭ�ԣ������Ը�������������������ӣ����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O�����Դ��ǣ�5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O����5�������»�����FeS��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2S��Һ�뺬FeSO4��Һ�������3��2��ϣ���Ϻ���Һ��c��S2����=
����2��FΪFeԪ�أ�λ�����ڱ��е������ڵڢ��壻�ǽ�����O��S�����⻯���ȶ���H2O����H2S�����Դ��ǣ��������ڵڢ��壻���ڣ���3���ҡ����ֱ�ΪAlO2����Al3+�е�һ�֣����߷�Ӧ���ӷ���ʽΪ��Al3++3AlO2��+6H2O=4Al��OH��3�������Դ��ǣ�Al3++3AlO2��+6H2O=4Al��OH��3������4���������Ӿ��л�ԭ�ԣ������Ը�������������������ӣ����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O�����Դ��ǣ�5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O����5�������»�����FeS��Ksp=6��10��18 mol2L��2 �� �����½�1.0��10��5molL��1��Na2S��Һ�뺬FeSO4��Һ�������3��2��ϣ���Ϻ���Һ��c��S2����= ![]() mol/L=6.0��10��6mol/L�����г���FeS���ɣ�������Һ��c��Fe2+����
mol/L=6.0��10��6mol/L�����г���FeS���ɣ�������Һ��c��Fe2+���� ![]() mol/L=10��12mol/L��������c��FeSO4����
mol/L=10��12mol/L��������c��FeSO4���� ![]() mol/L=2.5��10��12 mol/L�����Դ��ǣ����ڻ����2.5��10��12 mol/L��
mol/L=2.5��10��12 mol/L�����Դ��ǣ����ڻ����2.5��10��12 mol/L��

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�