题目内容
【题目】如图为原电池装置示意图。
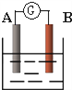
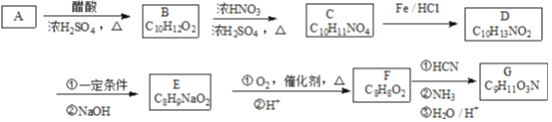
(1)若A为Pb,B为PbO2,电解质溶液为H2SO4溶液,电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。则该电池在工作时,A电极的质量将_______(填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为_______(设NA为阿伏加德罗常数的值)
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A极的电极反应式:__________________________;该电池工作一段时间后,溶液的碱性将___________(填“增强”、“减弱”或“不变”)。
【答案】 增加 0.1NA CH4+10OH- - 8e-= CO3-+ 7H2O 减弱
【解析】(1)根据反应式可知Pb失去电子转化为硫酸铅,铅作负极,即A电极是负极,则该电池在工作时,A电极的质量将增加。根据反应式可知消耗2mol硫酸转移2mol电子,若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为0.1NA;(2)甲烷在负极通入发生失去电子的氧化反应,电解质溶液显碱性,则A极的电极反应式为CH4+10OH--8e-=CO3-+7H2O;反应中消耗氢氧根离子,氢氧根浓度降低,因此该电池工作一段时间后,溶液的碱性将减弱。

练习册系列答案
相关题目
【题目】已知甲和乙的某些性质如表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.过滤B.蒸发C.蒸馏D.萃取