题目内容
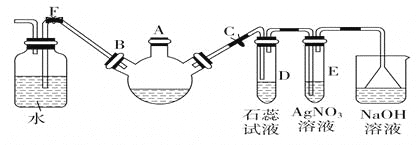
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
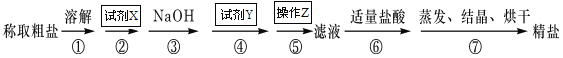
(1)试剂X的化学式为: ,试剂Y的化学式为: ,操作Z的名称: 。
(2)判断试剂X已过量的方法是
(3)第④步中,有关的离子方程式是 。
(4)下列仪器中,蒸发结晶时会用到的是 (写仪器名称)
![]()
![]()
![]()
(5)为检验精盐纯度,需配制1000mL 0.2 mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶。其正确的操作顺序应是_______ (填序号)。
A.B E F G C G D H A B.B E G A C G F D H
C.B E A G C G D F H D.B E A G C G D H F
②若定容时,仰视,会造成所配制的溶液浓度(填“偏高”或“偏低” ) 。
【答案】(1)BaCl2Na2CO3 过滤
(2)取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量. 或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量;
(3)Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(4)蒸发皿 (5)C ( 6 )偏低
【解析】试题分析:分析题给实验方案知为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,先将粗盐溶解,加入过量氯化钡溶液除去其中的SO42—,再加入过量的氢氧化钠溶液除去Mg2+,再加过量的碳酸钠溶液除去Ca2+和过量的Ba2+,过滤,除去不溶物,向滤液中加适量盐酸除去过量的氢氧化钠和碳酸钠,蒸发、结晶、烘干得精盐。
(1)试剂X的化学式为BaCl2,试剂Y的化学式为Na2CO3,操作Z的名称是过滤。
(2)判断试剂X已过量的方法是取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量. 或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量。
(3)第④步中,加入碳酸钠溶液除去粗盐中的Ca2+和过量的Ba2+,有关的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓。
(4)蒸发结晶时会用到的是蒸发皿。
(5)①配制1000mL 0.2 mol/L NaCl(精盐)溶液的实验步骤为称量、溶解、冷却、转移、洗涤、转移、定容、摇匀、装瓶,选C;②若定容时,仰视,所配溶液的体积偏大,会造成所配制的溶液浓度偏低。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
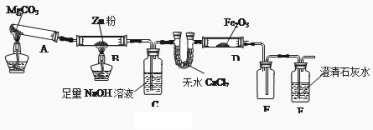
(1)MgCO3的分解产物为 。装置B中的反应方程式为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2(蓝色沉淀)
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③从实验安全考虑,上图装置还可采取的改进措施是 ;
④乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ,其验证方法为 。