题目内容
常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时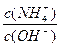 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点,理由是;
;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是 。
(1)①②(1分)②④(1分)
(2)①(1分)
(3)变大(1分)
(4)①c(1分)两溶液恰好反应生成NH4Cl,因NH4+水解促进水的电离,其它各点表示酸或碱剩余会抑制水的电离,故c点水的电离程度最大(2分)
②c(NH4 +)>c(Cl-)>c(OH-)>c(H+)(1分)
+)>c(Cl-)>c(OH-)>c(H+)(1分)
③c(Cl-)>c(NH4-)>c(Na+)(2分)
解析

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题: (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.