题目内容
有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀(说明:Ag2CO3为白色沉淀);
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是_______________,可能含有的成分是_______________。
(2)请写出上述实验中有关反应的离子方程式______________________________________。
【答案】
(1)KCl和K2CO3
KNO3(2)Ag++Cl-====AgCl↓,2Ag++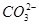 ====Ag2CO3↓,Ag2CO3+2H+====2Ag++H2O+CO2↑
====Ag2CO3↓,Ag2CO3+2H+====2Ag++H2O+CO2↑
【解析】由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K2CO3;又由沉淀不完全消失可知,一定含有KCl。

练习册系列答案
相关题目