题目内容
下列说法正确的是( )
| A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 |
| B.第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 |
| C.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 |
| D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
B
只要有氢原子,其原子就不可能满足最外层8电子结构。第ⅦA族元素形成的单质的熔点随原子序数的递增而增大。锂的燃烧产物是Li2O,所以答案是B。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
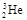 是较为安全的高效核聚变反应原料。
是较为安全的高效核聚变反应原料。