题目内容
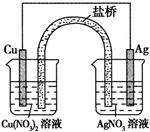
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )
①该原电池的正极应插入AgNO3溶液中
②负极反应为:Cu-2e-=Cu2+
③在外电路中,电流由铜电极流向银电极
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池的反应相同
⑤实验过程中取出盐桥,原电池仍继续工作.
①该原电池的正极应插入AgNO3溶液中
②负极反应为:Cu-2e-=Cu2+
③在外电路中,电流由铜电极流向银电极
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池的反应相同
⑤实验过程中取出盐桥,原电池仍继续工作.
分析:用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池,较为活泼的铜片为电池的负极,银为正极,负极发生氧化反应,正极发生还原反应,其中正极上氧化性较强的阴离子得电子被还原.
解答:解:①电解质中阳离子与相对应的电极材料属于相同元素,则银片应插入硝酸银溶液,故正确;
②负极上,铜失电子发生氧化反应,电极反应式为Cu2++2e-=Cu,故正确;
③外电路中,电流从正极银流向负极铜,故错误;
④原电池总反应为Cu+2Ag+=Cu2++2Ag,与将铜片浸入AgNO3溶液中发生的化学反应相同,故正确;
⑤实验过程中取出盐桥,不能形成闭合回路,所以不能继续工作,故错误;
故选C.
②负极上,铜失电子发生氧化反应,电极反应式为Cu2++2e-=Cu,故正确;
③外电路中,电流从正极银流向负极铜,故错误;
④原电池总反应为Cu+2Ag+=Cu2++2Ag,与将铜片浸入AgNO3溶液中发生的化学反应相同,故正确;
⑤实验过程中取出盐桥,不能形成闭合回路,所以不能继续工作,故错误;
故选C.
点评:本题考查原电池的工作原理,题目难度不大,本题注意电极反应式的书写,为解答该题的关键,明确盐桥的作用.

练习册系列答案
相关题目
 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是