题目内容
 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是b
b
(填序号).a.C(s)+H2O(g)
|
b.2H2(g)+O2(g)
|
c.NaOH(aq)+HCl(aq)
|
若以KOH溶液为电解质溶液,依据所选的反应设计一个原电池,其正极的电极反应式为
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
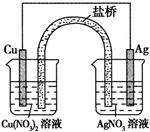
.某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的管)设计成一个原电池,如图所示,下列判断正确的是
d
d
(填序号).a.实验过程中,左侧烧杯中N
| O | - 3 |
b.实验过程中取出盐桥,原电池能继续工作
c.若开始时用U形铜代替盐桥,装置中无电流产生
d.若开始时用U形铜代替盐桥,U形铜的质量不变
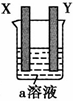
(2)电解原理在化学工业中有着广泛的应用.现将设计的燃料电池通过导线与如图所示的电解池相连,其中a溶液为电解液,X和Y均为惰性电极,则:
①若a溶液为CuSO4溶液,则电解时的化学方程式为
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
.
| ||
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL(标准状况下)气体时,溶液的pH=
1
1
(假设电解后溶液的体积不变).分析:(1)能设计成原电池的反应必须是自发的放热的氧化还原反应;原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应;
(2)①电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
②先根据离子放电顺序及溶液中溶质的物质的量确定阳极上析出的物质,再根据转移电子守恒计算阴极上析出的物质,根据溶液中氢离子浓度计算溶液的pH.
(2)①电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
②先根据离子放电顺序及溶液中溶质的物质的量确定阳极上析出的物质,再根据转移电子守恒计算阴极上析出的物质,根据溶液中氢离子浓度计算溶液的pH.
解答:解:(1)能设计成原电池的反应必须是自发的放热的氧化还原反应,
a是吸热反应,所以不能设计成原电池,故错误;
b是自发进行的放热的氧化还原反应,所以能设计成原电池,故正确;
c不是氧化还原反应,所以不能设计成原电池,故错误;
故选b;
若以KOH溶液为电解质溶液,正极上氧气得电子发生还原反应,电极反应式为 O2+4e-+2H2O=4OH-,
该原电池中,铜易失电子作负极,银作正极,
a.实验过程中,NO3-向负极铜电极移动,所以左侧烧杯中浓度增大,故错误;
b.实验过程中取出盐桥,该装置不能形成闭合回路,所以原电池不能继续工作,故错误;
c.若开始时用U形铜代替盐桥,则左侧构成电解池,右侧构成原电池,故错误;
d.若开始时用U形铜代替盐桥,则左侧构成电解池,右侧构成原电池,U型铜电极反应式从左向右依次为:Cu2++2e-=Cu、Cu-2e-=Cu2+,所以U型铜质量不变,故正确;
故选d;
故答案为:b;O2+4e-+2H2O=4OH-;d;
(2)①电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,所以电池反应式为
2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
②电解混合溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,0.04mol氯离子只能生成0.02mol氯气,即448mL氯气,转移0.04mol电子,共生成672mL气体,说明还有224mL气体来自于水的电解,根据
4OH--4e-=2H2O+O2↑知,生成224mL氧气又转移0.04mol电子,所以电解过程中一共转移0.08mol电子,阴极上先铜离子放电,电极反应式为:Cu2++2e-=Cu,现有0.04mol铜离子恰好完全电解析出,由此可得整个过程中消耗了0.04mol氢氧根离子,根据水的电离方程式知,溶液中氢离子浓度为0.04mol,则氢离子浓度为0.1mol/L,则溶液的pH=1,
故答案为:1.
a是吸热反应,所以不能设计成原电池,故错误;
b是自发进行的放热的氧化还原反应,所以能设计成原电池,故正确;
c不是氧化还原反应,所以不能设计成原电池,故错误;
故选b;
若以KOH溶液为电解质溶液,正极上氧气得电子发生还原反应,电极反应式为 O2+4e-+2H2O=4OH-,
该原电池中,铜易失电子作负极,银作正极,
a.实验过程中,NO3-向负极铜电极移动,所以左侧烧杯中浓度增大,故错误;
b.实验过程中取出盐桥,该装置不能形成闭合回路,所以原电池不能继续工作,故错误;
c.若开始时用U形铜代替盐桥,则左侧构成电解池,右侧构成原电池,故错误;
d.若开始时用U形铜代替盐桥,则左侧构成电解池,右侧构成原电池,U型铜电极反应式从左向右依次为:Cu2++2e-=Cu、Cu-2e-=Cu2+,所以U型铜质量不变,故正确;
故选d;
故答案为:b;O2+4e-+2H2O=4OH-;d;
(2)①电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,所以电池反应式为
2CuSO4+2H2O
| ||
| ||
②电解混合溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,0.04mol氯离子只能生成0.02mol氯气,即448mL氯气,转移0.04mol电子,共生成672mL气体,说明还有224mL气体来自于水的电解,根据
4OH--4e-=2H2O+O2↑知,生成224mL氧气又转移0.04mol电子,所以电解过程中一共转移0.08mol电子,阴极上先铜离子放电,电极反应式为:Cu2++2e-=Cu,现有0.04mol铜离子恰好完全电解析出,由此可得整个过程中消耗了0.04mol氢氧根离子,根据水的电离方程式知,溶液中氢离子浓度为0.04mol,则氢离子浓度为0.1mol/L,则溶液的pH=1,
故答案为:1.
点评:本题考查了原电池和电解池,明确原电池的构成条件、原电池原理及电解池原理是解本题关键,难点是(2)②溶液pH的计算,根据溶液中的溶质计算阳极上的产物,再结合转移电子相等进行解答即可,难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目

 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第