题目内容
【题目】常温下,向100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: 
(1)由图中信息可知HA为酸(填“强”或“弱”),理由是
(2)常温下一定浓度的MA稀溶液的pH=a,则a7(填“>”、“<”或“=”),用离子方程式表示其原因为;,此时,溶液中由水电离出的c(OH﹣)= .
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)2c(A﹣)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH﹣)=molL﹣1 .
【答案】
(1)强;0.01 mol?L﹣1HA的pH为2,说明HA完全电离
(2)<;M++H2O?MOH+H+;1×10﹣amol?L﹣1
(3)c(M+)>c(A﹣)>c(OH﹣)>c(H+)
(4)=;0.005
【解析】解:(1)根据图象知,0.01molL﹣1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸, 所以答案是:强;0.01 molL﹣1HA的pH为2,说明HA完全电离; (2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2OMOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH﹣)=1×10﹣amolL﹣1 ,
所以答案是:<;M++H2OMOH+H+;1×10﹣amolL﹣1;(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A﹣)>c(OH﹣)>c(H+),
所以答案是:c(M+)>c(A﹣)>c(OH﹣)>c(H+); (4)K点时,加入的MOH的物质的量=0.02molL﹣1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)= ![]() =0.01mol/L,
=0.01mol/L,
HA是强酸,所以反应后的溶液中,c(A﹣)= ![]() ×0.01molL﹣1=0.005molL﹣1 , 故c(M+)+c(MOH)=2c(A﹣);
×0.01molL﹣1=0.005molL﹣1 , 故c(M+)+c(MOH)=2c(A﹣);
根据电荷守恒可得:c(H+)+c(M+)=c(A﹣)+c(OH﹣),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L﹣c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L﹣c(MOH)=c(A﹣)+c(OH﹣),
整理可得:c(MOH)+c(OH﹣)=c(H+)+0.01mol/L﹣c(A﹣)=10﹣10mol/L+0.01mol/L﹣0.005molL﹣1≈0.005molL﹣1 ,
所以答案是:=;0.005.
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离平衡常数 | 1.8×10﹣5 | Ka1=5.4×10﹣2 | Ka1=1.3×10﹣7 |
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序
(3)H2C2O4与少量的KOH溶液反应的化学方程式:
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:
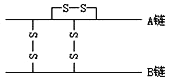
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号). ①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.