题目内容
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 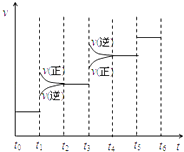
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
【答案】
(1)N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol;46
(2)加压;t2﹣t3
(3)![]()
(4)B
【解析】解:(1)反应热=生成物总键能﹣反应物总键能,则该反应的反应热=6×391kJ/mol﹣946kJ/mol﹣3×436kJ/mol=﹣92KJ/mol,该反应热化学反应方程式为N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol,生成2mol氨气放出92kJ热量,则生成1mol氨气放出46kJ热量,所以答案是:N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol;46 KJ;(2)该反应是反应前后气体体积减小的放热反应,改变条件时,正逆反应速率都增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,则改变的条件是加压,t3时平衡向逆反应方向移动,t5 时平衡不移动,所以平衡混合物中NH3的含量最高的一段时间是t2﹣t3 ,
所以答案是:加压;t2﹣t3;(3)氮气的转化率为50%,则平衡时c(N2)= ![]() =amol/L,c(NH3)=
=amol/L,c(NH3)= ![]() =2amol/L、c(H2)=
=2amol/L、c(H2)= ![]() =amol/L,化学平衡常数K=
=amol/L,化学平衡常数K= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;(4)浓度商=
;(4)浓度商= ![]() =0.1481>0.12,则平衡向逆反应方向移动,故选B.
=0.1481>0.12,则平衡向逆反应方向移动,故选B.
【考点精析】利用化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案