题目内容
16.金属是人类生产、生活中不可缺少的重要材料(1)生铁是C(填化学式)和铁的合金,生铁的硬度比纯铁高(填高、低)
(2)生铁放置在潮湿的空气中会发生电化学腐蚀,请书写钢铁表面的水膜酸性较强时发生腐蚀的电极方程式.
负极:Fe-2e-=Fe2+
正极:2H++2e-=H2↑
(3)用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O.
分析 (1)生铁为Fe、C的合金,合金的硬度比Fe的高;
(2)钢铁表面的水膜酸性较强时,发生析氢腐蚀,负极Fe失去电子,正极氢离子得到电子;
(3)用盐酸可以除去生铁表面的铁锈,氧化铁与盐酸反应生成氯化铁和水.
解答 解:(1)生铁是C和铁的合金,生铁的硬度比纯铁高,故答案为:C;高;
(2)钢铁表面的水膜酸性较强时,发生析氢腐蚀,负极Fe失去电子,正极氢离子得到电子,则负极反应为Fe-2e-=Fe2+,正极反应为2H++2e-=H2↑,
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;
(3)用盐酸可以除去生铁表面的铁锈,氧化铁与盐酸反应生成氯化铁和水,离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O.
点评 本题考查铁及合金的性质,为高频考点,把握物质的性质及发生的反应为解答关键,侧重分析与应用能力的考查,注意析氢腐蚀的条件,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
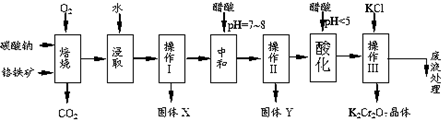
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;③Cr2O72-+H2O═2CrO42-+2H+.根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
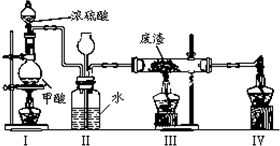
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如图:CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是III、I、IV.

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;③Cr2O72-+H2O═2CrO42-+2H+.根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如图:CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是III、I、IV.

7.据最新报道,科学家发现了如下反应:O2+PtF6→O2(PtF6),已知O2(PtF6)为离子化合物,其中的Pt为+5价,(PtF6)为某价态的原子团,对于此反应下列说法正确的是( )
| A. | 在此反应中,O2氧化剂,PtF6是还原剂 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子 | |
| D. | 在O2(PtF6)中不存在共价键 |
4.在下列各溶液中,离子一定能大量共存的是( )
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO${\;}_{3}^{-}$、SO42- |
1.控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )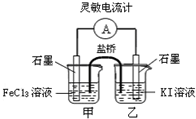

| A. | 反应开始时,乙中电极反应为2I-+2e-═I2 | |
| B. | 反应开始时,甲中石墨电极上发生氧化反应 | |
| C. | 电流表指针为零时,两池溶液颜色相同 | |
| D. | 平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极 |
8.一般来说,脂溶性的维生素主要积存在人体的( )
| A. | 大脑 | B. | 肌肉 | C. | 血液 | D. | 肝脏 |
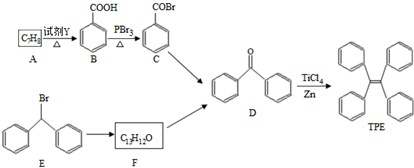
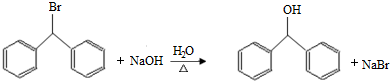 .
.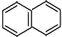 )的一元取代物;
)的一元取代物;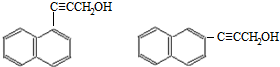 .
.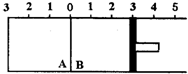 如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入2molSO3(g),在体积相同的条件下发生可逆反应:2SO2+O2?2SO3.根据下列要求填写空白:
如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入2molSO3(g),在体积相同的条件下发生可逆反应:2SO2+O2?2SO3.根据下列要求填写空白: