题目内容
某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.4mol/L.现将一定量的铁粉投入到该溶液中,回答下列问题:
(1)CuCl2的电离方程式为______,铁粉投入后反应的离子方程式为______.
(2)原溶液中Cu2+的浓度为______mol/L.
(3)反应后测得Cl-的浓度为______mol/L.
(4)若反应后测得Fe2+的溶液为0.1mol/L,则反应生成铜单质的质量为______g.剩余的Cu2+的浓度为______mol/L.
(1)CuCl2的电离方程式为______,铁粉投入后反应的离子方程式为______.
(2)原溶液中Cu2+的浓度为______mol/L.
(3)反应后测得Cl-的浓度为______mol/L.
(4)若反应后测得Fe2+的溶液为0.1mol/L,则反应生成铜单质的质量为______g.剩余的Cu2+的浓度为______mol/L.
(1)CuCl2为强电解质,完全电离,电离方程式为CuCl2=Cu2++2Cl-;加入铁粉发生置换反应生成Cu,发生离子反应为Fe+Cu2+=Fe2++Cu,
故答案为:CuCl2=Cu2++2Cl-;Fe+Cu2+=Fe2++Cu;
(2)由CuCl2可知,2c(Cu2+)=c(Cl-)=0.4mol/L,所以c(Cu2+)=0.2mol/L,故答案为:0.2;
(3)氯离子不参加反应,反应前后不变,c(Cl-)=0.4mol/L,故答案为:0.4;
(4)由n=cV可知,n(Fe2+)=n(Cu)=n(Cu2+)反应=0.1mol/L×0.1L=0.01mol,m(Cu)=0.01mol×64g/mol=0.64g,
剩余的Cu2+的浓度为
=0.1mol/L,故答案为:0.64;0.1.
故答案为:CuCl2=Cu2++2Cl-;Fe+Cu2+=Fe2++Cu;
(2)由CuCl2可知,2c(Cu2+)=c(Cl-)=0.4mol/L,所以c(Cu2+)=0.2mol/L,故答案为:0.2;
(3)氯离子不参加反应,反应前后不变,c(Cl-)=0.4mol/L,故答案为:0.4;
(4)由n=cV可知,n(Fe2+)=n(Cu)=n(Cu2+)反应=0.1mol/L×0.1L=0.01mol,m(Cu)=0.01mol×64g/mol=0.64g,
剩余的Cu2+的浓度为
| 0.1L×0.2mol/L-0.01mol |
| 0.1L |

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
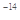 mol
mol ,满足此条件的溶液中一定可以大量共存的离子组是:
,满足此条件的溶液中一定可以大量共存的离子组是: