题目内容
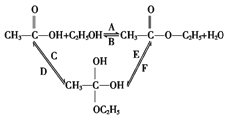
【题目】(1)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B);反应可能经历了生成中间体(Ⅰ),过程如图所示.在A~F 6个反应中,属于加成反应的是______________(填字母)。
(2)按要求写出下列化学术语
ⅰ.已知在一定的条件下2CH3CH2OH→CH3CH2OCH2CH3+H2O,则类比写出CH3CH(OH)CH2CH3发生同样类型反应的化学方程式_______________________________,反应类型为_____________;
ⅱ.写出A(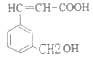 )发生下列反应的方程式:
)发生下列反应的方程式:
①A+钾→__________________________,
②A发生加聚反应__________________________;
ⅲ.已知在一定温度和压强下,1g氢气在氯气中充分燃烧生成HCl气体,放出热量为a,则在相同条件下断开1molH-H键和1molCl-Cl键所吸收的能量比形成2molH-Cl键所放出的能量______(填“多”或“少”)_______kJ。
ⅳ.用化学反应方程式表示冶炼银的反应原理__________________________。
【答案】(1)CE (2)ⅰ. 2CH3CH(OH)CH2CH3![]()
![]() +H2O
+H2O
ⅱ.①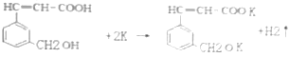 ②
② 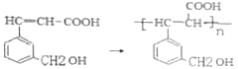
ⅲ.少 2akJ ⅳ.2Ag2O![]() 2Ag+O2↑
2Ag+O2↑
【解析】
试题分析:(1)A反应,乙酸中的羟基被CH3CH2O-取代生成乙酸乙酯,该反应属于取代反应;B中乙酸乙酯水解为A的逆反应,属于取代反应;C反应,乙酸中碳氧双键打开,与乙醇发生加成,属于加成反应;
E中,乙酸乙酯和水发生加成反应;F中,一种物质生成两种物质,属于消去反应;D反应产物乙酸中含有碳氧双键,E反应中生成乙酸乙酯中含有碳氧双键,所以这两反应属于消去反应;故选CE。
(2)ⅰ.CH3CH(OH)CH2CH3发生取代反应生成醚的化学方程式 2CH3CH(OH)CH2CH3![]()
![]() +H2O ;
+H2O ;
ⅱ.①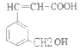 分子结构中的羧基与羟基均能与K发生反应生成氢气,则反应的方程式为
分子结构中的羧基与羟基均能与K发生反应生成氢气,则反应的方程式为![]() ;
;
②含有碳碳双键的有机物可以发生加聚反应,![]() 发生加聚反应的方程式为
发生加聚反应的方程式为![]() ;
;
ⅲ.氢气在氯气中充分燃烧生成HCl气体的反应放出热量,可知反应物键断裂吸收的热量小于生成物键形成放出的热量;则断开1molH-H键和1molCl-Cl键所吸收的能量比形成2molH-Cl键所放出的能量少2akJ。
ⅳ.银是不活泼金属,可利用热分解的方法冶炼,反应方程式为2Ag2O![]() 2Ag+O2↑。
2Ag+O2↑。

 名校课堂系列答案
名校课堂系列答案【题目】I.雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) △H1= a kJ·mol-1
2NO(g) △H1= a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) △H2= b kJ·mol-1
2NO2(g) △H2= b kJ·mol-1
③CO(g)+1/2 O2(g)![]() CO2(g) △H3= c kJ·mol-1
CO2(g) △H3= c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H4
N2(g)+2CO2(g) △H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4= kJ·mol-1。
(2)下列情况能说明反应②已达平衡状态的是 (填编号)。
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.混合气体的颜色保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
II.甲醇是重要的化工原料,又可作为燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是___________________(填序号)。
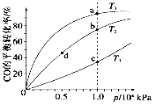
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2。某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
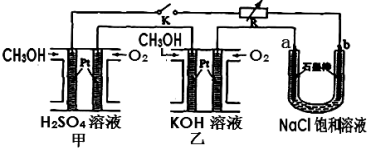
则乙燃料电池的负极反应式为 。
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为如图:
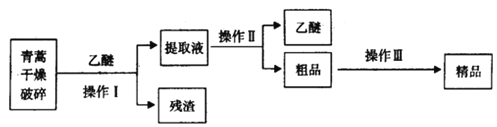
(1)对青蒿进行干燥破碎的目的是_________________________________;
(2)操作I需要的玻璃仪器主要有:烧杯、______________,操作Ⅱ的名称是______________;
(3)操作Ⅲ的主要过程可能是______________(填字母);
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
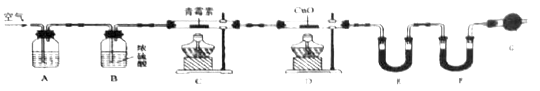
①装置A、E、F中盛放的物质分别是_________、__________、__________;
②G的作用是____________________________;
③
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的最简式是______________,欲确定其分子式,则还需要的物理量为____________;
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______________(填字母)具有相同的性质;
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:
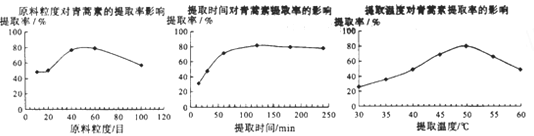
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为______________。
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃
【题目】根据如表所列键能数据,下列分子中最不稳定的分子是( )
化学键 | H﹣H | H﹣Cl | H﹣Br | CI﹣CI | Br﹣Br |
键能( KJmol﹣1) | 436 | 431 | 299 | 247 | 193 |
A.HCl B.HBr C.H2 D.Br2
