题目内容
【题目】I.雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) △H1= a kJ·mol-1
2NO(g) △H1= a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) △H2= b kJ·mol-1
2NO2(g) △H2= b kJ·mol-1
③CO(g)+1/2 O2(g)![]() CO2(g) △H3= c kJ·mol-1
CO2(g) △H3= c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H4
N2(g)+2CO2(g) △H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4= kJ·mol-1。
(2)下列情况能说明反应②已达平衡状态的是 (填编号)。
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.混合气体的颜色保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
II.甲醇是重要的化工原料,又可作为燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是___________________(填序号)。
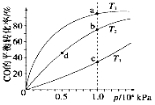
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2。某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
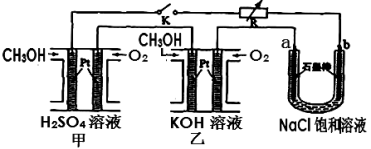
则乙燃料电池的负极反应式为 。
【答案】I.(1)2c-a (2) CD II.(1)吸热 (2)K1K2 (3)> (4)C
(5) 2CH3OH-12e-+16OH-=2CO32-+12H2O
【解析】
试题分析:I.(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4=(2c-a)KJ/mol;
(2)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;B.密度=![]() ,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;C.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故C正确;D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;故选CD。
,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;C.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故C正确;D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;故选CD。
II.(1)反应②CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应;
(2)平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1K2;
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL-1、0.8molL-1、0.3molL-1、0.15molL-1,Q=![]() =0.88<K=2.5,则此时v正>v逆;
=0.88<K=2.5,则此时v正>v逆;
(4)A.根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,故A错误;B.反应速率v(c)>v(a),v(b)>v(d),故B错误;C.温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d),故C正确;故选C。
(5)在碱性溶液中,CH3OH碱性燃料电池中,负极CH3OH失电子被氧化,反应式为:2CH3OH-12e-+16OH-=2CO32-+12H2O;