题目内容
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
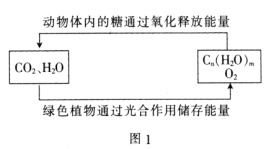
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
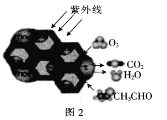
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
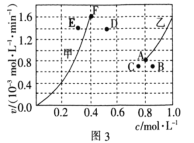
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
【答案】nCO2+mH2O ![]() Cn(H2O) m+nO2 5O3+3CH3CHO
Cn(H2O) m+nO2 5O3+3CH3CHO![]() 6CO2+6H2O +248 kJ/mol 乙 E 吸热 4×10-6 1.25×10-3
6CO2+6H2O +248 kJ/mol 乙 E 吸热 4×10-6 1.25×10-3
【解析】
(1)绿色植物在光照条件下将CO2、H2O反应转化为Cn(H2O) m,同时放出O2;
(2)根据图示的反应物、生成物,结合原子守恒书写方程式;
(3)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②CH4与CO2其起始的物质的量浓度均为1.0 mol/L,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,据此判断,根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移,甲烷的浓度会增大,据此判断;
(4)①根据表中温度对产生气体的浓度的影响分析,根据表中数据求反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)的平衡常数,要利用表中数据求出NH3、CO2的浓度,带入平衡常数表达式进行计算;
2NH3(g)+CO2(g)的平衡常数,要利用表中数据求出NH3、CO2的浓度,带入平衡常数表达式进行计算;
②利用化学平衡常数的含义,将物质的浓度带入平衡常数定义式,结合物质的电离平衡常数计算分析。
(1)绿色植物在光照条件下将CO2、H2O反应转化为Cn(H2O) m,同时放出O2,反应的方程式为:nCO2+mH2O ![]() Cn(H2O) m+nO2;
Cn(H2O) m+nO2;
(2)O3在TiO2及紫外线作用下将CH3CHO氧化为CO2,O3被还原为CO2、H2O,反应方程式为:5O3+3CH3CHO![]() 6CO2+6H2O;
6CO2+6H2O;
(3)①(i)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
(ii)CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
(iii)CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
Z根据盖斯定律,将(i)-4×(ii)+2×(iii),整理可得反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=+248 kJ/mol;
2CO(g)+2H2(g)的 △H=+248 kJ/mol;
②CH4与CO2其起始的物质的量浓度均为1.0 mol/L,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,所以曲线v正-c(CH4)相对应的是图中曲线是乙线,根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,所以此时曲线甲对应的平衡点可能为B点,CO的浓度也会减小,对应的为E点;
(4)①从表中数据可以看出,随着温度升高,气体的总浓度增大,说明升高温度,化学平衡正向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应分析移动,因此该反应为吸热反应;根据表中数据可知,在15℃时,c(NH3)=3×10-2×![]() mol/L=2×10-2 mol/L,c(CO2)=3×10-2×
mol/L=2×10-2 mol/L,c(CO2)=3×10-2×![]() mol/L=1×10-2 mol/L,,所以反应NH2COONH4(s)
mol/L=1×10-2 mol/L,,所以反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)的平衡常数K=c2(NH3)×c(CO2)=(2×10-2mol)
2NH3(g)+CO2(g)的平衡常数K=c2(NH3)×c(CO2)=(2×10-2mol)
②已知常温下NH3H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
=1.25×10-3。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案