题目内容
下列事实与结论(或推论)均正确的是
| A.将氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,说明所得溶液中c(Ag+)·c(Cl-)>Ksp(AgCl) |
| B.物质的量之比为1: 2的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3 |
| C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加NaOH溶液,立即产生红褐色沉淀;那么向FeI2溶液中通入少量的氯气,也会出现同样的现象 |
| D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2 |
B
解析试题分析:A、氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,是因为氯化银与一水合氨生成了氢氧化二氨合银配合物的缘故,错误;B、物质的量之比为1: 2的Na2O2和NaHCO3的固体混合物,NaHCO3受热分解产生的二氧化碳恰好与过氧化钠反应,生成碳酸钠,所以残留的固体是Na2CO3,正确;C、向FeBr2溶液中通入少量的氯气,氯气先与亚铁离子反应生成铁离子,所以加入氢氧化钠溶液有红褐色沉淀生成,而向FeI2溶液中通入少量的氯气,氯气先与碘离子反应生成单质碘,所以加入氢氧化钠溶液不会出现红褐色沉淀,错误;D、将某混合气体通入品红溶液中,溶液不褪色,该气体中无二氧化硫气体,错误,答案选B。
考点:考查对反应产物、反应事实、反应原理及结论的判断

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Na2O2使酚酞溶液变红 | Na2O2能漂白织物、纸浆 |
| B | SO2可使石蕊溶液先变红后褪色 | SO2的水溶液具有酸性和漂白性 |
| C | NH3、HCl可用作喷泉实验 | NH3、HCl都极易溶于水 |
| D | 晶体硅是良好的半导体材料 | 晶体硅可制作太阳能电池和光导纤维 |
下列实验“操作和现象”与“结论”对应关系正确的是
| | 操作和现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中,无明显变化 | Al与浓硝酸不反应 |
| B | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热, 红色加深。 | 说明盐类水解是吸热反应 |
| C | 向FeCl3溶液加入足量的铜粉,充分反应,静置,取上层清液 滴加几滴KSCN溶液,溶液不变血红色。 | 说明氧化性:Fe3+>Cu2+ |
| D | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
下列实验现象中烟雾的解释不正确的是
| A | B | C | D |
 |  | 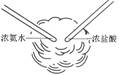 | 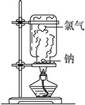 |
| 白雾:成分是盐 酸小液滴 | 白雾:成分是空气中的水蒸气 | 白烟:成分是氯化铵固体颗粒 | 白烟:NaCl固体颗粒 |
化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
| A.小苏打——Na2CO3 | B.消石灰——Ca (OH)2 |
| C.甲醛——CH3OH | D.明矾——KAl(SO4)2 |
下列说法不正确的是
| A.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| B.浓硝酸在光照下发黄,说明浓硝酸不稳定 |
| C.SO2、NO2分别与水发生的反应均为氧化还原反应 |
| D.水泥、普通玻璃、陶瓷等都是传统的硅酸盐制品 |
下列物质的转化在给定条件下能实现的是
①Al2O3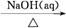 NaAlO2(aq)
NaAlO2(aq)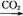 Al(OH)3
Al(OH)3
②S SO3
SO3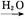 H2SO4
H2SO4
③Fe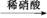 Fe2+
Fe2+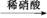 Fe3+
Fe3+
④Fe2O3 FeCl3(aq)
FeCl3(aq)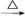 无水FeCl3
无水FeCl3
⑤MgCl2(aq) Mg(OH)2
Mg(OH)2 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
根据下列实验现象,所得结论正确的是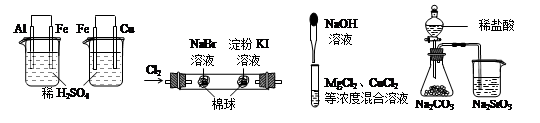
A B C D
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 先生成蓝色沉淀,后产生白色沉淀 | 溶度积常数:Mg(OH)2<Cu(OH)2 Cu(OH)2Mg(OH)2<Cu(OH)2MgMg(OH)2<Cu(OH)2Mg(OH)2<Cu(OH)2 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
下列说法正确的是( )
| A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| B.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 |
C.在粗硅的制取中,2C+SiO2 Si+2CO↑硅被还原,所以硅的非金属性比碳强 Si+2CO↑硅被还原,所以硅的非金属性比碳强 |
| D.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后通CO2 |