题目内容
19.2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11.2 LNO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是( )
| A.0.8 mol | B.1.1 mol | C.1.2 mol | D.2.0 mol |
B
试题分析:Cu与硝酸反应,开始是浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸变稀,这时发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。可见在反应中硝酸的作用有两个:一是形成Cu(NO3)2;二是得到电子变为气态氧化物NO、NO2。n(Cu)="m÷M" ="19.2g÷" 64g/mol=0.3mol.n(气体)=V÷Vm= 11.2 L÷22.4L/mol=0.5mol.所以n(HNO3)=2n(Cu)+ n(气体)="2×" 0.3mol+ 0.5mol=1.1mol。故选项为B。

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目



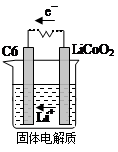
 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。