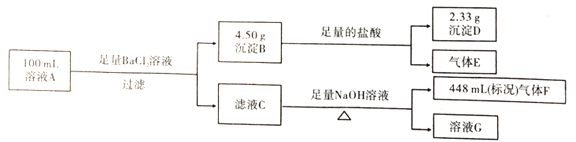
题目内容
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。

【答案】![]() 哑铃形(或纺锤形) O>N>As < 分子晶体 (0,
哑铃形(或纺锤形) O>N>As < 分子晶体 (0,![]() ,
,![]() )
) ![]()
【解析】
根据元素核外电子排布规律分析元素的种类;根据元素周期律比较电负性大小;根据晶体的性质判断晶体类型;根据晶胞的结构进行相关计算。
基态A原子的价电子排布式为nsnnpn,则A的价电子排布式为2s22p2,A为C元素;C原子基态时2p能级上有2个未成对的电子,则C为氧元素,因为A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,则B为氮元素;D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,则D原子3d轨道上电子数目为8,则D为28号元素镍;B与E同主族,则E为砷;
(1)基态碳原子的价电子轨道表示式为![]() ;其电子占据的最高能级为2p能级,p轨道的电子云形状为:哑铃形(或纺锤形);
;其电子占据的最高能级为2p能级,p轨道的电子云形状为:哑铃形(或纺锤形);
(2)非金属性越强电负性越强,同周期元素核电荷数越大电负性越大,故电负性:O>N,同主族元素核电荷数越小电负性越大,故电负性:N>As,故答案为:O>N>As;
(3)相同非金属元素对应的含氧酸中,元素化合价越高,酸性越强,则二者酸性强弱H3EO3<H3EO4;
(4)该配合物为无色挥发性液态,说明熔沸点较低,构成晶体的微粒间以范德华力结合,则该配合物的晶体类型是分子晶体;
(5)根据图示坐标轴的方向,a为原点,坐标参数为(0,0,0),则b的坐标参数为(![]() ,
,![]() ,0),则c离子的坐标参数为(0,
,0),则c离子的坐标参数为(0,![]() ,
,![]() );图中单层分子可以如图画出一维重复单元:
);图中单层分子可以如图画出一维重复单元: 重复单元呈平行四边形,所占面积,S=2x×
重复单元呈平行四边形,所占面积,S=2x×![]() x=
x=![]() m2,每个重复单元包含1个O原子和1个Ni原子,则1m2上该晶体的质量为
m2,每个重复单元包含1个O原子和1个Ni原子,则1m2上该晶体的质量为![]() g。
g。