题目内容
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
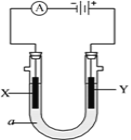
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则电解池中Y极上的电极反应式是________________。
在Y极附近放湿润的淀粉碘化钾试纸观察到的现象是_________________。
②X电极上发生的反应属于__________ 反应。
③电解后X极产生白色沉淀,则该沉淀最有可能是(填化学式)_______。
⑵如要用电解方法实现将铁片镀上一层金属银,电解液a选用硝酸银溶液,则
①X电极的材料是_________。
②Y电极反应式是___________________________________________。
③已知开始时铁片与银片的质量相同,当电路中有0. 4摩尔电子通过时,两极质量相差___________克。
【答案】 2Cl -2e - = Cl2↑ 变蓝 还原 Mg(OH)2 铁 Ag – e - = Ag+ 86.4克
【解析】(1)①与电源正极相连的Y电极为阳极,溶液中氯离子失电子发生氧化反应,Y电极上的电极反应式是:2Cl -2e - =Cl2↑;氯气具有氧化性,能把碘化钾氧化为单质碘,因此在Y极附近放湿润的淀粉碘化钾试纸观察到的现象是溶液变蓝;②电解池中X极是阴极,溶液中氢离子得到电子生成铜,发生还原反应;③由于电解后产生氢氧化钠,溶液显碱性,因此如果电解后X极产生白色沉淀,则该沉淀最有可能是氢氧化镁;(2)①铁片镀上一层金属银时阳极是银,阴极是铁,X电极是阴极,则X电极的材料是铁;②Y电解是阳极,银失去电子,电极反应式为Ag–e- =Ag+;③假若电路中有0.4mol电子通过时,阳极电极反应Ag–e- =Ag+,阴极增重质量=0.4mol×108g/mol=43.2g,阳极减少43.2g,所以两极质量相差86.4g。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】下列四个图中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的字母填入表中:
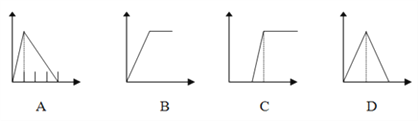
溶液 | 加入的物质 | 图像字母 |
AlCl3溶液 | 通过量的NH3 | ___ |
饱和石灰水 | 通CO2至过量 | ___ |
NaAlO2溶液 | 滴加稀盐酸至过量 | ___ |
含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ___ |