题目内容
在2L的密闭容器中,一定条件下发生化学反应:2NO( g)+ 2CO(g)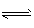 N2(g)+2CO2(g) △H=-746.4 kJ·mol-1。起始反应时NO和CO 各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g) △H=-746.4 kJ·mol-1。起始反应时NO和CO 各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
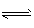 N2(g)+2CO2(g) △H=-746.4 kJ·mol-1。起始反应时NO和CO 各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g) △H=-746.4 kJ·mol-1。起始反应时NO和CO 各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是 [ ]
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·(L·s)-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 molO2,正、逆反应速率都不改变
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 molO2,正、逆反应速率都不改变
C

练习册系列答案
相关题目
一定条件下,在2L的密闭容器中通入4.0mol的N2和适量的H2,发生反应:N2(g)+3H2(g)?2NH3(g).经过5s后,测得N2剩余2.0mol,在这5S内N2的反应速率为( )
| A、0.3 mol.L-1?s-1 | B、0.2mol?L-1?s-1 | C、0.4 mol?L-1?s-1 | D、0.5 mol.L-1?s-1 |