题目内容
对于可逆反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
| 催化剂 |
| 加热 |
分析:A.加压,逆向移动,但不能完全转化;
B.达到平衡时,若两种反应物的转化率相等,则反应物的起始量之比等于化学计量数之比;
C.向压强固定的密闭容器中充入稀有气体,相当于反应体系的压强减小;
D.v正(NH3):v正(NO)=1:1,只能说明正反应速率的关系.
B.达到平衡时,若两种反应物的转化率相等,则反应物的起始量之比等于化学计量数之比;
C.向压强固定的密闭容器中充入稀有气体,相当于反应体系的压强减小;
D.v正(NH3):v正(NO)=1:1,只能说明正反应速率的关系.
解答:解:A.加压,逆向移动,但不能完全转化,则平衡不能总是向逆反应方向移动,故A错误;
B.达到平衡时,若两种反应物的转化率相等,则反应物的起始量之比等于化学计量数之比,即起始投入的n (NH3 ):n (O2 )=4:5,故B正确;
C.向压强固定的密闭容器中充入稀有气体,相当于反应体系的压强减小,平衡正向移动,故C错误;
D.v正(NH3):v正(NO)=1:1,只能说明正反应速率的关系,只有正逆反应相等可确定化学反应达到平衡,故D错误;
故选B.
B.达到平衡时,若两种反应物的转化率相等,则反应物的起始量之比等于化学计量数之比,即起始投入的n (NH3 ):n (O2 )=4:5,故B正确;
C.向压强固定的密闭容器中充入稀有气体,相当于反应体系的压强减小,平衡正向移动,故C错误;
D.v正(NH3):v正(NO)=1:1,只能说明正反应速率的关系,只有正逆反应相等可确定化学反应达到平衡,故D错误;
故选B.
点评:本题考查化学平衡的影响因素,把握压强对化学平衡的影响及平衡的判断为解答的关键,注意选项A中平衡不能总是移动为易错点,明确可逆反应不能完全转化,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )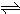
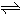 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )