��Ŀ����
��1����һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ��±������ա�N2ѹ��1.0��105Pa����Ӧʱ��3h������÷�Ӧ������ӦΪ
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
��3���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã������ڸ�������ˮ������Ӧ��Ӧ����ʽΪ��CH4��g��+H2O��g��=CO��g��+3H2��g�����������ʵ�ȼ�����������£�
H2��g������H=-285.8kJ?mol-1��
CO��g������H=-283.0kJ?mol-1��
CH4��g������H=-890.3kJ?mol-1��
��֪1mol H2O��g��ת��Ϊ1mol H2O��l��ʱ�ų�44.0kJ������д��CH4��H2O�ڸ����·�Ӧ���Ȼ�ѧ����ʽ
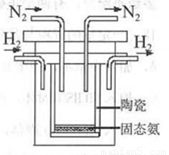
��4����������Ѱ���ʺϵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl--NH4ClΪ�������Һ�Ƴ�����ȼ�ϵ�أ���д���õ缫��������Ӧʽ
��5�����ɵ�NH3���������̬���ʣ��磨NH4��2SO4��NH4Cl����Щ������
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+��2������Ӱ�컯ѧ��Ӧ�����Լ�ƽ���ƶ������ط�����
��3�����ø�˹�������㷴Ӧ�ȣ�
��4����N2��H2Ϊ�缫��Ӧ���HCl--NH4ClΪ�������Һ�Ƴ�����ȼ�ϵ�أ�����������ԭ��Ӧ��N2�õ�������NH4+��
��5����NH4��2SO4��NH4Cl��Ϊǿ�������Σ�ˮ������ԣ�
��2���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ�ʹ��ѧƽ��������Ӧ�����ƶ����Ӷ�����NH3�������������¶�Ҳ����߷�Ӧ���ʣ�����ӦN2Ũ�ȣ��ӿ췴Ӧ���ʣ���ʹ��ѧƽ�������ƶ��������Ƴ����������뷴Ӧ��ϵ��ʹƽ�������ƶ�������NH3��������
�ʴ�Ϊ�������¶ȡ�����N2��Ũ�ȣ�
��3���ɱ������ݿ�֪����H2��g��+
| 1 |
| 2 |
��CO��g��+
| 1 |
| 2 |
��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3 kJ?mol-1��
��H2O��g��=H2O��l����H=-44.0kJ?mol-1��
���ø�˹���ɣ�����+��-�١�3-�ڿɵã�CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
�ʴ�Ϊ��CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
��4��ԭ�������������ԭ��Ӧ��N2�õ�������NH4+���缫��ӦʽΪN2+6e-+8H+=2NH4+���ʴ�Ϊ��N2+8H++6e-=2NH4+��
��5����NH4��2SO4��NH4Cl��Ϊǿ�������Σ�ˮ������ԣ�����Һ�з�����NH4++H2O
 NH3H2O+H+����ʹ��ʱҪ������������ʻ��ʹ�ã���ֹ���ͷ�Ч��
NH3H2O+H+����ʹ��ʱҪ������������ʻ��ʹ�ã���ֹ���ͷ�Ч���ʴ�Ϊ���NH4++H2O
 NH3H2O+H+�����ԣ�
NH3H2O+H+�����ԣ�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�(7��) ��ѧ��һֱ�����ڡ��˹��̵����ķ����о���
��Ŀǰ�ϳɰ��ļ���ԭ��Ϊ��
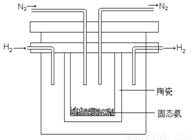
�÷�Ӧ�������仯��ͼ��ʾ��

���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�ǣ� �������������С�����䡱����
�ڽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
������ߢ�������H2��ת���ʣ����д�ʩ���е��� ��
A���������а�ԭ�����ٳ���ԭ���� B�����������ٳ����������
C���ı䷴Ӧ�Ĵ��� D��Һ��������������
��1998��ϣ������ʿ��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+�����Ӷ�ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ�����ʵ��װ����ͼ��ʾ�������ĵ缫��ӦʽΪ ��

�Ǹ������¡��˹��̵������о��������ڳ��¡��� ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��

��һ���о�NH3���������¶ȹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
|
T/K |
303 |
313 |
323 |
|
NH3������/��10��6mol�� |
4.8 |
5.9 |
6.0 |
�ٺϳɷ�Ӧ��a_ 0��������ڡ�����С�ڡ����ڡ���
����֪

��
��14�֣�
��ѧ��һֱ�����ڡ��˹��̵����ķ����о���
��Ŀǰ�ϳɰ��ļ���ԭ��Ϊ��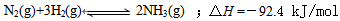
�÷�Ӧ�������仯��ͼ��ʾ��

���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�ǣ� �������������С�����䡱����
�ڽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
������ߢ�������H2��ת���ʣ����д�ʩ���е��� ��
A���������а�ԭ�����ٳ���ԭ����
B�����������ٳ����������
C���ı䷴Ӧ�Ĵ���
D��Һ��������������
��1998��ϣ������ʿ��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+�����Ӷ�ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ�����ʵ��װ����ͼ��ʾ�������ĵ缫��ӦʽΪ ��
�Ǹ������¡��˹��̵������о��������ڳ��¡��� ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��

��һ���о�NH3���������¶ȹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
|
T/K |
303 |
313 |
323 |
|
NH3������/��10��6mol�� |
4.8 |
5.9 |
6.0 |
�ٴ˺ϳɷ�Ӧ��a_ 0��������ڡ�����С�ڡ����ڡ���
����֪

�� NH4Cl��Һ�����ԣ���������NH ˮ���Ե�ʡ���NH4Cl����ˮ��D2O����ˮ������ӷ���ʽ��
��
ˮ���Ե�ʡ���NH4Cl����ˮ��D2O����ˮ������ӷ���ʽ��
��
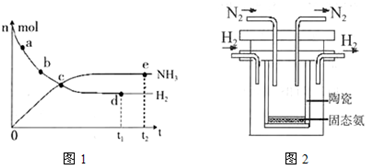
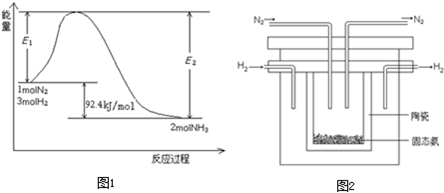
 2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
 2H+���������ĵ缫��ӦΪ��_____________��
2H+���������ĵ缫��ӦΪ��_____________��