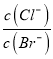题目内容
【题目】工业上采用CO2与NH3为原料合成尿素[CO(NH2)2],反应原理为:
①2NH3 +CO2=H2NCOONH4; ②H2NCOONH4=CO(NH2)2 + H2O
(1)将一定量![]() =3的原料气通入合成塔中,在分离出的气体中测得
=3的原料气通入合成塔中,在分离出的气体中测得![]() =6,则该反应中CO2的转化率(CO2转化率=
=6,则该反应中CO2的转化率(CO2转化率=![]() ×100%)为______。
×100%)为______。
(2)合成中氨碳比[![]() ]、水碳比[
]、水碳比[![]() ]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。
]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。

(3)实验室用以下装置模拟第一步反应合成H2NCOONH4(氨基甲酸铵)的实验。
已知:H2NCOONH4遇水易发生非氧化还原反应,生成碳酸铵或碳酸氢铵。

①装置A用于制备氨气,则固体M可以是______或______。
②反应中若有水存在,写出生成碳酸氢铵反应的化学方程式______。
③选用干冰提供CO2的优点是______。装置C为吸收尾气的装置,导管未插入液面以下的目的是______。
【答案】75% 4 190~195℃(或190~195℃任意值) 碱石灰 CaO CO2+NH3+H2O=NH4HCO3(或写成H2NCOONH4 +H2O=NH4HCO3+NH3) 快速简便的制备CO2(或保证参与反应的CO2无水) 防止倒吸
【解析】
(1)由![]() 的起始量和分离出的量计算反应消耗的二氧化碳的量,再由转化率公式计算既得;
的起始量和分离出的量计算反应消耗的二氧化碳的量,再由转化率公式计算既得;
(2)由图可知,氨碳比为4、反应温度在190~195℃范围时,CO2的平衡转化率最大;
(3)由实验装置图可知,装置A用浓氨水与氧化钙固体或氢氧化钠固体或碱石灰反应制备氨气,并用盛有碱石灰的干燥管干燥氨气;装置B用干冰升华制备干燥二氧化碳气体;二氧化碳气体和氨气在硬质玻璃管中反应生成氨基甲酸铵,为防止氨基甲酸铵水解,用盛有碱石灰的干燥管吸收二氧化碳,并防止水蒸气进入硬质玻璃管中;用盛有稀硫酸的洗气瓶吸收过量的氨气,防止污染环境。
(1)若起始n(CO2)为1mol,则n(NH3)为3mol,设消耗n(CO2)为xmol,由方程式可知分离出的气体中![]() =
=![]() =6,解得x=0.75mol,则的转化率为
=6,解得x=0.75mol,则的转化率为![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(2)由图可知,氨碳比为4、反应温度在190~195℃范围时,CO2的平衡转化率最大,故答案为:4;190~195℃(或190~195℃任意值);
(1)①装置A用浓氨水与氧化钙固体或氢氧化钠固体或碱石灰反应制备氨气,故答案为:碱石灰;CaO;
②反应中若有水存在,氨气、二氧化碳和水反应生成碳酸氢铵,或反应生成的氨基甲酸铵发生水解反应生成碳酸氢铵,反应的化学方程式为CO2+NH3+H2O=NH4HCO3或H2NCOONH4 +H2O=NH4HCO3+NH3,故答案为:CO2+NH3+H2O=NH4HCO3(或写成H2NCOONH4 +H2O=NH4HCO3+NH3);
③装置B用干冰升华快速简便制备干燥二氧化碳气体;若导管未插入液面下,氨气与稀硫酸反应会产生倒吸,故答案为:快速简便的制备CO2(或保证参与反应的CO2无水);防止倒吸。

 阅读快车系列答案
阅读快车系列答案