��Ŀ����
����Ŀ����ѧ��ѧ�м��ֳ������ʵ�ת����ϵ��ͼ��ʾ(ͼ�в��ַ�Ӧ��������P��Ӧ����δ�г�)��
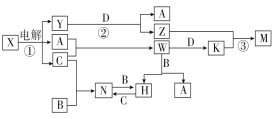
��֪��A��B��C��D�ǵ��ʣ������ǻ��������B��D�dz��������������B��Ԫ�����ڹ���Ԫ�ء���֪A��C�е�ȼ�в�ɫ���棬M�ȿ����������ֿ�����NaOH��Һ����ش��������⣺
��1��W�ĵ���ʽ�� ��
��2��д��N�Ļ�ѧʽ ������дһ��N����Ҫ��; ��
��3��д�����з�Ӧ�����ӷ���ʽ��
��Ӧ�� ��
��Ӧ�� ��
K��Һ������ˮ��Ӧ ��
���𰸡���1�� ![]()
��2��FeCl3 ��������������ˮ����ӡˢ��·ͭ�帯ʴ��������ֹѪ����(��дһ��)
��3��2Cl����2H2O![]() 2OH����H2����Cl2�� Al3����3AlO2����6H2O=4Al(OH)3��
2OH����H2����Cl2�� Al3����3AlO2����6H2O=4Al(OH)3��
Al3����3NH3��H2O=Al(OH)3����3NH4��
��������
�����������֪��A��B��C��D�ǵ��ʣ������ǻ��������B��D�dz��������������B��Ԫ�����ڹ���Ԫ�أ����B��������֪A��C�е�ȼ�в�ɫ���棬����A��H��C��Cl��M�ȿ����������ֿ�����NaOH��Һ��˵��M������������������������ת��ͼ��֪D������Y����Al��Ӧ�������������Y��ǿ���������ƣ���X��NaCl��Z��ƫ�����ƣ�W���Ȼ��⣬K���Ȼ������Ȼ�����ƫ�����Ʒ�Ӧ����������������M����������������������Ӧ�����������Ȼ��������Ȼ�������������Ӧ�����Ȼ������Ȼ���������Ӧ���Ȼ���������N���Ȼ�����
��1���Ȼ��������ۻ��������ʽ��![]() ��
��
(2N�Ļ�ѧʽ��FeCl��N����Ҫ��;Ϊ����������ˮ����ӡˢ��·ͭ�帯ʴ��������ֹѪ���ȡ�
��3���������Ϸ�����֪��Ӧ�������ӷ���ʽΪ2Cl����2H2O![]() 2OH����H2����Cl2������Ӧ�������ӷ���ʽΪAl3����3AlO2����6H2O=4Al(OH)3����K��Һ������ˮ��Ӧ�����ӷ���ʽΪAl3����3NH3��H2O=Al(OH)3����3NH4����
2OH����H2����Cl2������Ӧ�������ӷ���ʽΪAl3����3AlO2����6H2O=4Al(OH)3����K��Һ������ˮ��Ӧ�����ӷ���ʽΪAl3����3NH3��H2O=Al(OH)3����3NH4����

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����2016����ɽ��ģ������������һ�ֹ�ҵ�Σ������ʳ�ηdz����ƣ����Խ�ǿ��ij��ѧ��ȤС���ʳ�����������ƽ��ж�Ƕ�̽����
��һ������NaCl��NaNO2
��ͬѧ�ó���������
���飺������Ksp(AgNO2)=2��10-8�� Ksp(AgCl)=1.8��10-10���ֱ���ʢ��5mL 0.0001 mol/L��������Һ���Ժ���ͬʱ��εμ�0.0001mol/L��������Һ�������ɳ�������װ�� ��Һ���Թܡ�
��ͬѧ�ඨ��ҺpH
��pH��ֽ�ֱ�ⶨ0.1 mol/L��������Һ��pH�����NaNO2��Һ�ʼ��ԡ�����Һ�ʼ��Ե�ԭ���� �������ӷ���ʽ���ͣ���
��������С��������װ�ã���ȥ�г��������Ʊ���������

��֪���� 2NO+ Na2O2 = 2NaNO2 ��
�� ���������£�NO��NO2������MnO4һ��Ӧ����NO3һ��Mn2+��
��1��ʹ��ͭ˿���ŵ��� ��
��2��װ��A�з�Ӧ����ʽΪ ��
װ��C ��ʢ�ŵ�ҩƷ�� ��������ĸ���ţ�
A��Ũ���� B��NaOH ��Һ C��ˮ D�����Ȼ�̼
����F������ ��
��3����С���ȡ5.000g��ȡ����Ʒ����ˮ���250.0 mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.70 | 20.12 | 20.00 | 19.88 |
�� ��һ��ʵ�����ݳ����쳣����������쳣��ԭ������� ������ĸ���ţ���
A����ƿϴ����δ����
B����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
C���ζ��յ�ʱ���Ӷ���
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ ��
������Ʒ���������Ƶ���������Ϊ ��