题目内容
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。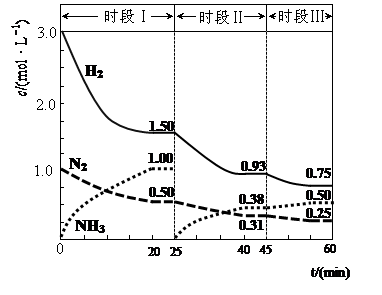
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。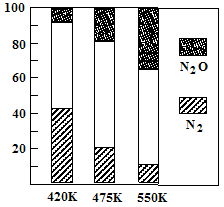
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
(16分)有效数字错误或无单位扣1分
(1)①0.050mol?L-1?min-1 (2分) 47.2kJ (2分)
② 将NH3从反应体系中分离出去 (2分)
③  (3分)
(3分)
(2)随温度升高,N2的含量降低 (2分) 主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(2分)
(3)2NH3 + 6OH-—6e-= N2+ 6H2O (3分)
解析试题分析:(1)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L?min),注意保留两位有效数字;氮气由1.0mol/L逐渐减小到0.50mol/L,根据c?V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L1L=0.50mol,由于N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
考点:考查化学反应原理,涉及平均反应速率的计算、根据反应物或生成物的变化量计算反应过程中放出的热量、根据反应速率和化学平衡图像判断改变的外界条件、指定阶段下平衡常数的计算表达式、从图中得出温度对平衡移动的影响规律、解释原因、燃料电池的负极反应式等。

(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
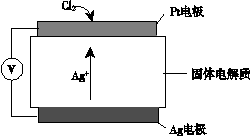
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
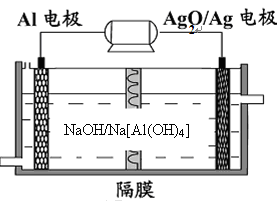
请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4 =□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的平均反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=____ _____,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
① 2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应式为: ;
②该电池工作时,溶液中的OH-向______(填“正”或“负”)极移动。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | | |
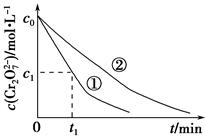
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
____________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和 。
(4)该实验小组用如图实验装置进行实验。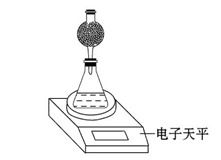
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有 。
②干燥管中应放置的试剂是 。
| A.碱石灰 | B.无水CaCl2 |
| C.P2O5固体 | D.浓硫酸 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH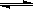 CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) =-49.0kJ·mol
=-49.0kJ·mol
 ,曲线Ⅰ对应条件下平衡常数为
,曲线Ⅰ对应条件下平衡常数为 ,曲线Ⅱ对应条件下平衡常数为
,曲线Ⅱ对应条件下平衡常数为 ,则
,则